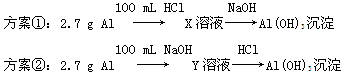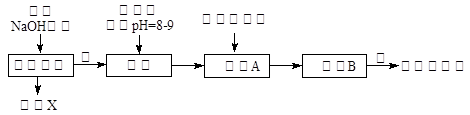题目内容
(1)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是 (填名称),
可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)通常情况下,微粒X和Y为分子,Z和W为阳离子,E为阴离子,它们都含有10个电子;
Y溶于X后所得的物质可电离出Z和E;X、Y、W三种微粒反应后可得Z和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:X: Y : Z: E :
②写出两个X、Y、W三种微粒反应的离子方程式: 、
可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)通常情况下,微粒X和Y为分子,Z和W为阳离子,E为阴离子,它们都含有10个电子;
Y溶于X后所得的物质可电离出Z和E;X、Y、W三种微粒反应后可得Z和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:X: Y : Z: E :
②写出两个X、Y、W三种微粒反应的离子方程式: 、
(1) 镁 b、c
(2)①H2O NH3 NH4+ OH-
②Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+
(2)①H2O NH3 NH4+ OH-
②Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+
试题分析:(1)室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,判断甲是铝元素,乙元素原子的M电子层与K电子层上的电子数相等,说明乙是镁元素,甲、乙两元素相比较,金属性较强的是镁;验证金属性的强弱,可以通过与同浓度酸或水反应的剧烈程度、最高价氧化物的水化物的碱性的强弱、单质的置换反应等,(a)在空气中放置已久的这两种元素的块状单质的表面存在氧化膜,不与水反应,不能判断,所以答案选bc;
(2)①10电子的分子有Ne、HF、H2O 、 NH3、CH4,Y能溶于X可电离出Z和E,说明X为H2O,Y是NH3,Z是NH4+,E是OH-,X、Y、W三种微粒反应后可得Z和一种白色沉淀,10电子微粒中阳离子与氨水反应能形成沉淀的有Al3+、Mg2+,不能确定W的具体离子;
②Al3+、Mg2+与氨水反应的离子方程式分别为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+

练习册系列答案
相关题目