题目内容
(2012?南开区一模)下列叙述正确的是( )
分析:A.碱金属的密度随原子序数的增加而呈增大的趋势;
B.非金属的非金属性越强,其最高价氧化物对应水化物的酸性越强;
C.活泼金属采用电解其熔融盐的方法冶炼;
D.蒸发溶液时促进弱根离子水解.
B.非金属的非金属性越强,其最高价氧化物对应水化物的酸性越强;
C.活泼金属采用电解其熔融盐的方法冶炼;
D.蒸发溶液时促进弱根离子水解.
解答:解:A.钠的密度大于钾的密度,故A错误;
B.C、P、S、Cl的非金属性逐渐增强,则其最高价氧化物对应水化物的酸性逐渐增强,故B正确;
C.电解氯化镁溶液时阴极上析出氢气,电解氯化铁溶液时,阴极上铁离子得电子生成亚铁离子,故C错误;
D.蒸发FeCl3、CuCl2溶液时,铁离子和铜离子易水解,且氯化氢易挥发,从而使铁离子和铜离子水解程度增大,最终得不到氯化铁和氯化铜,故D错误;
故选B.
B.C、P、S、Cl的非金属性逐渐增强,则其最高价氧化物对应水化物的酸性逐渐增强,故B正确;
C.电解氯化镁溶液时阴极上析出氢气,电解氯化铁溶液时,阴极上铁离子得电子生成亚铁离子,故C错误;
D.蒸发FeCl3、CuCl2溶液时,铁离子和铜离子易水解,且氯化氢易挥发,从而使铁离子和铜离子水解程度增大,最终得不到氯化铁和氯化铜,故D错误;
故选B.
点评:本题涉及碱金属的元素周期律、非金属性与其相应最高价酸的关系、金属的冶炼等知识点,注意电解氯化铁溶液时,阴极上是铁离子得电子而不是氢离子得电子,为易错点.

练习册系列答案
相关题目
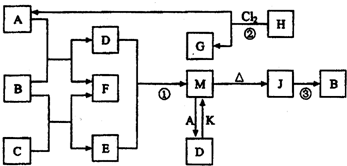 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为