题目内容
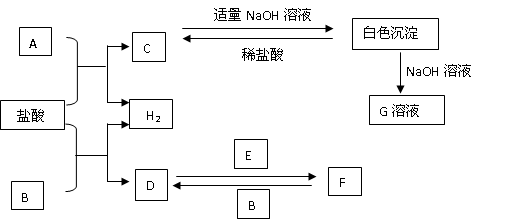
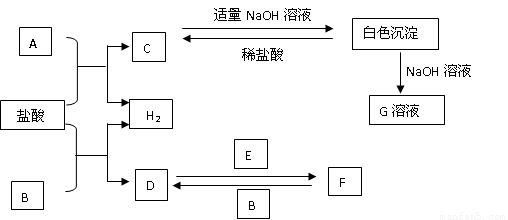
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图所示的转化.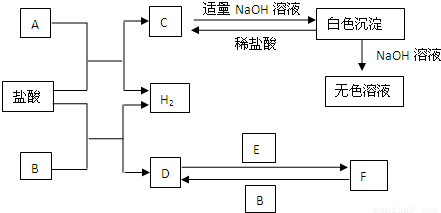
试回答下列问题:
(1)A在周期表中的位置是______;
(2)检验F中金属阳离子的常用方法是______;
(3)白色沉淀与NaOH溶液反应的离子方程式是______;
(4)反应F→D的化学方程式是______.
【答案】分析:A、B均是常见的金属,且B的合金用量最大推断为Fe;D为FeCl2,E在常温下是黄绿色气体推断E为Cl2;所以判断F为FeCl3;A+HCl=H2+C,C+NaOH=白色沉淀,沉淀溶于氢氧化钠溶于,推断A为Al,C为AlCl3;结合判断出的物质分析回答问题;
解答:解:A、B均是常见的金属,且B的合金用量最大推断为Fe;D为FeCl2,E在常温下是黄绿色气体推断E为Cl2;所以判断F为FeCl3;A+HCl=H2+C,C+NaOH=白色沉淀,沉淀溶于氢氧化钠溶于,推断A为Al,C为AlCl3;结合判断出的物质分析回答问题;
(1)A为Al,在周期表中的位置是第三周期,第ⅢA族;故答案为:第三周期,第ⅢA族;
(2)检验F中金属阳离子是Fe3+,检验的常用方法是:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子的存在;
故答案为:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子;
(3)白色沉淀是氢氧化铝与NaOH溶液反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O;故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)反应F→D是FeCl3生成FeCl2的反应,反应的化学方程式是:2FeCl3+Fe=3FeCl2;故答案为:2FeCl3+Fe=3FeCl2;
点评:本题考查了物质转化关系的分析判断,物质性质的综合应用,主要考查了铁及其化合物,铝及其化合物性质的应用,题目难度中等.
解答:解:A、B均是常见的金属,且B的合金用量最大推断为Fe;D为FeCl2,E在常温下是黄绿色气体推断E为Cl2;所以判断F为FeCl3;A+HCl=H2+C,C+NaOH=白色沉淀,沉淀溶于氢氧化钠溶于,推断A为Al,C为AlCl3;结合判断出的物质分析回答问题;
(1)A为Al,在周期表中的位置是第三周期,第ⅢA族;故答案为:第三周期,第ⅢA族;
(2)检验F中金属阳离子是Fe3+,检验的常用方法是:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子的存在;
故答案为:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子;
(3)白色沉淀是氢氧化铝与NaOH溶液反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O;故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)反应F→D是FeCl3生成FeCl2的反应,反应的化学方程式是:2FeCl3+Fe=3FeCl2;故答案为:2FeCl3+Fe=3FeCl2;
点评:本题考查了物质转化关系的分析判断,物质性质的综合应用,主要考查了铁及其化合物,铝及其化合物性质的应用,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目