题目内容
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
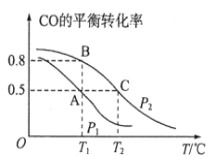
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
【答案】< KA=KB>KC b 100 减小 >
【解析】
(1)①根据压强对平衡状态的影响分析判断;
②平衡常数只受温度影响,据图分析,随温度升高CO转化率降低,说明正反应放热;
③达到化学平衡时,正逆反应速率相等,各组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
(2)根据CO的转化率利用三段式法计算平衡常数;根据浓度对平衡状态的影响分析;
(3)计算此时浓度商和平衡常数比较判断反应进行的方向。
(1)①反应CO(g)+2H2(g)![]() CH3OH(g)是气体体积减小的反应,加压平衡正向移动,反应物转化率增大,所以PA<PB;
CH3OH(g)是气体体积减小的反应,加压平衡正向移动,反应物转化率增大,所以PA<PB;
②据图分析,随温度升高CO转化率降低,说明正反应放热,升温平衡逆向移动,平衡常数减小,所以KA=KB>KC;
③a.H2的消耗速率是CH3OH生成速率的2倍,都是正反应速率,不能说明反应达到平衡状态,故a错误;
b.CH3OH的体积分数不再改变说明正逆反应速率相等,反应达到平衡状态,故b正确;
c.容器体积和气体质量始终不变,所以混合气体的密度始终不变,因此密度不变不能说明反应达到平衡状态,故c错误;
d.CO和甲醇的化学计量数都为1,所以CO和CH3OH的物质的量之和始终保持不变,不能说明反应达到平衡状态,故d错误;
故答案为b;
(2)P1压强、T1℃时CO的转化率为0.5,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.1 0.2 0
转化浓度(mol/L) 0.05 0.1 0.05
平衡浓度(mol/L) 0.05 0.1 0.05
化学平衡常数K=![]() =100;
=100;
若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,氢气的转化率增大,CO的转化率减小;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时反应的浓度商Qc=![]() =50<K=100,此时v正>v逆。
=50<K=100,此时v正>v逆。