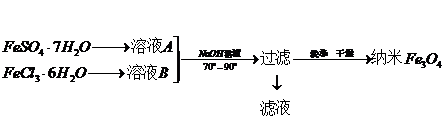题目内容
11.在一固定容积的A容器中盛有40%的H2和60%的O2(体积分数)的混合气体,试求:(1)其中H2与O2的分子数之比是2:3,质量比是1:24
(2)混合气体在标准状况下的密度是0.893g/L
(3)在某温度(高于100℃)时,引燃A容器中的气体,回复到原来温度,则A容器内混合气体的平均式量是25;引燃前后,A容器内压强如何变化减小(填“增大”“减小”或“不变”,下同);A容器内混合气体的密度如何变化不变.
分析 (1)相同条件下,气体分子数目之比等于其体积之比;物质的量之比等于体积之比,根据m=nM计算二者质量之比;
(2)计算平均相对分子质量,标况下密度=$\frac{M}{{V}_{m}}$;
(3)设 n(H2)=2 mol n(O2)=3 mol,发生反应:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O(g),混计算反应后合气体总物质的量,结合M=$\frac{m}{n}$计算反应后式量;相同条件下,气体压强之比等于物质的量之比;混合气体总质量不变,体积不变,则密度不变.
解答 解:(1)相同条件下,气体分子数目之比等于体积之比,H2与O2的分子数之比=40%:60%=2:3,则H2与O2的质量之比=2×2:3×32=1:24,
故答案为:2:3;1:24;
(2)混合气体的平均摩尔质量=2g/mol×40%+32g/mol×60%=20g/mol,故标况下,混合气体的密度=$\frac{20g/mol}{22.4L/mol}$=0.893g/L,
故答案为:0.893g/L;
(3)设 n(H2)=2 mol n(O2)=3 mol,则反应前n总=5 mol,
发生反应:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O(g),由方程式可知氧气剩余,则反应后 n′(O2)=3mol-1 mol=2mol,n(H2O)(g)=2 mol,n′总=4mol,
反应前后混合气体总质量不变,故容器内混合气体的平均式量是$\frac{2×2+32×3}{4}$=25;
相同条件下,气体压强之比等于物质的量之比,故反应后压强减小;
混合气体总质量不变,体积不变,则容器内混合气体的密度不变,
故答案为:25;减小;不变.
点评 本题考查混合物有关计算,难度不大,侧重对基础知识的巩固.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与3mol溴水发生反应 | |
| C. | 胡椒酚所有原子可能共面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 6 | 0.2 | 5 | 0.2 | 9 |
| C | 35 | 8 | 0.15 | 10 | 0.1 | 2 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
| A. | FeCl2 | B. | H2S | C. | S | D. | HCl |
| A. | 单质的沸点:W>X | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 阴离子的还原性:Y>Z | D. | X与Y不能存在于同一离子化合物中 |
| A. | HCl→H2 | B. | HCl→FeCl2 | C. | Fe→Fe2O3 | D. | H2SO4(浓)→SO2 |

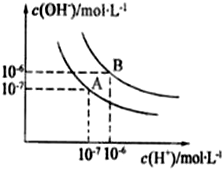 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.