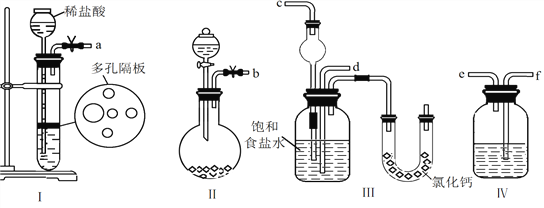
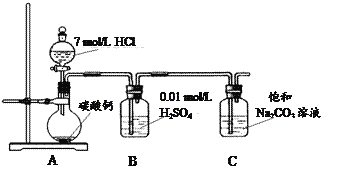
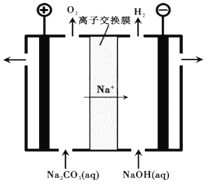
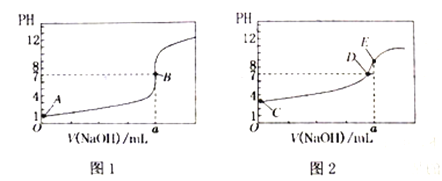
��Ŀ����
����Ŀ����Ҫ������
(1)����(CH4)��Ħ������Ϊ_________��
(2)0.5mol H2������Ϊ______����״���¸���������Ϊ_________��
(3)5molCO2������ԭ�ӵ���ĿΪ__________����
(4)100mL0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����__________mol/L��
(5)��200mL�Ȼ�þ���Ȼ����Ļ����Һ������c(Mg2+)Ϊ0.2mol/L��c(Cl��)Ϊ1.6mol/L����Al3+�����ʵ���Ũ��Ϊ______________mol/L��
���𰸡�16 g/mol 1 g 11.2 L 10NA ����6.02��1024�� 0.5 0.4
��������
(1) Ħ��������g/molΪ��λ����ֵ�ϵ�����Է������������Լ���(CH4)��Ħ������Ϊ16 g/mol���𰸣�16 g/mol��
(2)����m=n![]() M=0.5mol
M=0.5mol ![]() 2 g/mol =1g������0.5molH2������Ϊ1g����״���¸���������ΪV=nVm=0.5mol
2 g/mol =1g������0.5molH2������Ϊ1g����״���¸���������ΪV=nVm=0.5mol ![]() L/mol=11.2 L���𰸣�1 g ��11.2 L��
L/mol=11.2 L���𰸣�1 g ��11.2 L��
(3)����N=nNA=5mol![]() 2
2![]() 6.02��1023mol-1=6.02��1024��5molCO2������ԭ�ӵ���ĿΪ10NA ��6.02��1024���𰸣�10NA ��6.02��1024��
6.02��1023mol-1=6.02��1024��5molCO2������ԭ�ӵ���ĿΪ10NA ��6.02��1024���𰸣�10NA ��6.02��1024��
(4)����Na2SO4![]() 2 Na+������0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����0.5mol/L ���𰸣�0.5��
2 Na+������0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����0.5mol/L ���𰸣�0.5��
(5)��Al3+�����ʵ���Ũ��Ϊx mol/L�����ݵ���غ���c(Mg2+)![]() 2+c(Al3+)��3= c(Cl��)����Ϊ��0.2
2+c(Al3+)��3= c(Cl��)����Ϊ��0.2![]() 2+3xmol/L=1.6mol/L ��x=0.4 ������Al3+�����ʵ���Ũ��Ϊ0.4mol/L���𰸣�0.4
2+3xmol/L=1.6mol/L ��x=0.4 ������Al3+�����ʵ���Ũ��Ϊ0.4mol/L���𰸣�0.4