题目内容
某同学为了探究SO2与Na2O2的反应是否类似于CO2,设计反应装置见图.
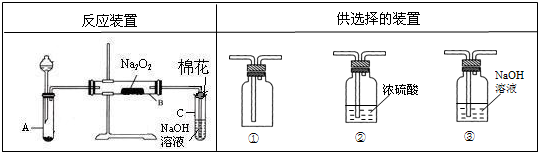
(1)选择制取SO2的合适试剂______;
a.10%的H2SO4溶液 b.80%的H2SO4溶液 c.Na2SO3固体 d.CaSO3固体
(2)装置C中NaOH溶液的作用是______;
(3)上述反应装置有些不足之处,为完善该装置,请从供选择的装置中选择需要的装置______(填编号),说明所选装置在整套装置中的位置______;
(4)移开棉花,将带火星的木条放在C试管口,木条不复燃,该同学认为SO2与Na2O2的反应不同于CO2,请据此写出反应的化学方程式______;
(5)为检验是否有Na2SO4生成,设计如下方案

上述方案______(填“合理”、“不合理”),理由:______;
(6)Na2O2反应完全后,为确定所得固体的组成,可进行如下操作:称取样品m g并溶于适量的水中,______(选择下列操作的编号按操作顺序填入),烘干,称量,干燥沉淀质量为n g,计算含量.
a.加足量盐酸酸化的氯化钡溶液;b.加足量硫酸酸化的氯化钡溶液;c.过滤;d.洗涤; e.蒸发结晶.
解:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水).
故答案为:bc
(2)SO2有毒,直接排放到空气中污染环境.
故答案为:吸收多余的SO2,防止污染环境
(3)进入B装置的气体应该干燥,故应将②加在A和B之间.
故答案为:②;将②加在A和B之间
(4)木条不复燃,说明没有氧气生成,Na2O2有强氧化性,有SO2较强的还原性,产物应为Na2SO4,方程式为:
SO2+Na2O2=Na2SO4.
故答案为:SO2+Na2O2=Na2SO4
(5)在检验是否有Na2SO4生成时,要考虑到Na2SO3的干扰,因为SO32-有较强的还原性,可被过氧化钠氧化成SO42-.故答案为:不合理;如果固体中还有未反应的Na2O2,也能氧化亚硫酸钠为硫酸钠.
(6)将Na2SO4转化成BaSO4沉淀,通过称量BaSO4沉淀的质量,计算含量,故应为acd
故答案为:acd
分析:(1)根据实验室制备SO2的原理,强酸制弱酸;
(2)SO2有毒,直接排放到空气中污染环境;
(3)进入B装置的气体应该干燥;
(4)根据Na2O2有强氧化性,有SO2较强的还原性,结合木条不复燃,书写方程式;
(5)根据检验SO42-的方法,同时考虑SO32-的干扰;
(6)将Na2SO4转化成BaSO4沉淀,通过称量BaSO4沉淀,计算含量.
点评:本题为研究性试题,以探究过氧化钠与二氧化硫的反应为依托,考查知识的迁移能力、设计和评价实验方案的能力.
故答案为:bc
(2)SO2有毒,直接排放到空气中污染环境.
故答案为:吸收多余的SO2,防止污染环境
(3)进入B装置的气体应该干燥,故应将②加在A和B之间.
故答案为:②;将②加在A和B之间
(4)木条不复燃,说明没有氧气生成,Na2O2有强氧化性,有SO2较强的还原性,产物应为Na2SO4,方程式为:
SO2+Na2O2=Na2SO4.
故答案为:SO2+Na2O2=Na2SO4
(5)在检验是否有Na2SO4生成时,要考虑到Na2SO3的干扰,因为SO32-有较强的还原性,可被过氧化钠氧化成SO42-.故答案为:不合理;如果固体中还有未反应的Na2O2,也能氧化亚硫酸钠为硫酸钠.
(6)将Na2SO4转化成BaSO4沉淀,通过称量BaSO4沉淀的质量,计算含量,故应为acd
故答案为:acd
分析:(1)根据实验室制备SO2的原理,强酸制弱酸;
(2)SO2有毒,直接排放到空气中污染环境;
(3)进入B装置的气体应该干燥;
(4)根据Na2O2有强氧化性,有SO2较强的还原性,结合木条不复燃,书写方程式;
(5)根据检验SO42-的方法,同时考虑SO32-的干扰;
(6)将Na2SO4转化成BaSO4沉淀,通过称量BaSO4沉淀,计算含量.
点评:本题为研究性试题,以探究过氧化钠与二氧化硫的反应为依托,考查知识的迁移能力、设计和评价实验方案的能力.

练习册系列答案
相关题目



 某同学为了探究硫与氧气的反应情况,装配好如图所示得装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢地回到原先标定的刻度。简要回答下列问题:
某同学为了探究硫与氧气的反应情况,装配好如图所示得装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢地回到原先标定的刻度。简要回答下列问题: 

