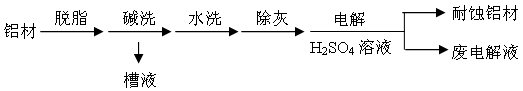
题目内容
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是

A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)

A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
D
试题分析:A项中,CH4失去电子,电子流出,故通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,正确;
B项中,0<V≤22.4L,即2n(CH4)≤n(KOH),产物为K2CO3,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C项中,22.4L<V≤44.8L,即n(KOH)≤2n(CH4)≤2n(KOH),产物由K2CO3转向KHCO3,故负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-,正确;
D项中,V=33.6L,1.5n(CH4)=2n(KOH),溶液中溶质是K2CO3和KHCO3为1:1 CO32-水解生成HCO3-,且比HCO3-水解程度大,故c(HCO3- )>c(CO32- )>c(OH-),错误。

练习册系列答案
相关题目


 H3O++Cl-
H3O++Cl-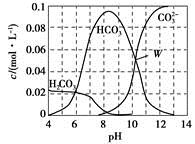
 )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-) )+c(
)+c( Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )