题目内容
【题目】一定温度下,将a molSO3气体通入体积为V L的密闭容器中发生如下反应:2SO3=2SO2+O2 , 一段时间之后测得生成氧气的物质的量为b mol(2b<a),则这段时间内,反应前后气体的压强比为 , 反应前后气体的密度比为 , 反应后气体的平均相对分子质量为 . (化简到最简整数比)
【答案】a:(a+b);1:1;![]()
【解析】解:将a molSO3气体通入体积为V L的密闭容器中发生如下反应:2SO3=2SO2+O2 , 一段时间之后测得生成氧气的物质的量为b mol(2b<a),则 2SO3=2SO2+O2 ,
起始:a 0 0
转化:2b 2b b
一段时间后:a﹣2b 2b b
则反应后气体的物质的量为a﹣2b+2b+b=a+b,
则反应前后气体的压强比为a:(a+b),
由于气体的质量不变,容器的体积不变,则反应前后气体的密度不变,为1:1,
反应前气体的质量为80ag,反应后气体的质量也为80ag,而物质的量为(a+b)mol,则反应后气体的平均相对分子质量为 ![]() .
.
所以答案是:a:(a+b);1:1; ![]() .
.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下列各组物质中,X是主体物质,Y是少量杂质,Z是除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cl2 | Fe | NaOH溶液 | BaCl2溶液 |
A.A
B.B
C.C
D.D
【题目】1000ml某无色待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、CO32﹣、HCO3﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH﹣(浓)=NH3↑+H2O)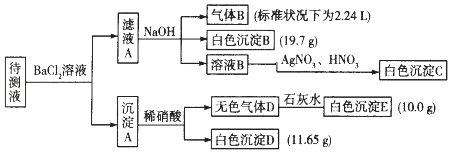
(1)原溶液中肯定存在的离子是(除Na+) , 肯定不存在的离子是 .
(2)写出生成白色沉淀B的离子方程式: . 写出沉淀A溶于稀硝酸的离子方程式: .
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是 .