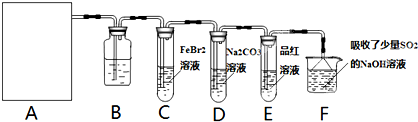
题目内容
氯气是一种重要的化工原料,除了用于消毒、制备盐酸和漂白剂外,还用于制备有机溶剂和农药。请你通过对氯气性质的研究完成下列问题。
(1)下列有关氯气的叙述中,不正确的是()
A.氯气是一种黄绿色、 有刺激性气味的气体
B.氯气、液氯和氯水是同一物质
C.氯气能溶于水
D.氯气是一种有毒的气体
(2)下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是()
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
(3)实验室用下列两种方法制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。则所得Cl2()
A.①比②多 B.②比①多 C.一样多 D.无法比较
(4)把氯气通入紫色石蕊溶液后,可以观察到的现象是 。请你解释其中的原因: 。
(1)B (2)D (3)B (4)现象是:溶液颜色先变红,后逐渐褪为无色。
解释:因为氯气与水反应生成了盐酸和次氯酸:Cl2+H2O![]() HCl+HClO,溶液此时呈酸性,使紫色石蕊溶液变红,又因为次氯酸具有漂白性,把白蕊这种有机色质漂白,溶液红色又褪去。
HCl+HClO,溶液此时呈酸性,使紫色石蕊溶液变红,又因为次氯酸具有漂白性,把白蕊这种有机色质漂白,溶液红色又褪去。
解析:
本题考查氯气及其化合物的有关性质变化和实验室制备的反应原理。
(1)通过观察可知,氯气是一种黄绿色的有刺激性气味的气体,A选项正确;氯气、液氯和氯水中都含同一种物质——Cl2,氯气和液氯是Cl2的不同状态,是纯净物,属于同一种物质,但氯水中除了Cl2以外,还有H2O,以及Cl2与H2O反应生成的HCl和HClO,因此B选项的叙述不正确;氯气能溶于水,通常状况下,1体积水约能溶解2体积的Cl2,C选项正确;氯气有毒,D选项也正确。
(2)由Cl2的化学性质可知,2Fe+3Cl2![]() 2FeCl3,Cu+Cl2
2FeCl3,Cu+Cl2![]() CuCl2,2Al+3Cl2
CuCl2,2Al+3Cl2![]() 2AlCl3,而Cu与稀盐酸不反应,Fe+2HCl
2AlCl3,而Cu与稀盐酸不反应,Fe+2HCl![]() FeCl2+H2↑,2Al+6HCl
FeCl2+H2↑,2Al+6HCl![]() 2AlCl3+3H2↑,故选D。
2AlCl3+3H2↑,故选D。
(3)从HCl与MnO2反应的化学方程式可知146 g HCl与87 g MnO2恰好完全反应,但制Cl2时须用浓HCl才能反应。①中反应进行一段时间后,随盐酸浓度降低,反应不再进行,故146 g HCl不能完全反应;②中浓HCl足量,故MnO2可完全反应。因此②产生气体多。
(4)氯气通入紫色石蕊溶液后,溶液颜色应先变红,后逐渐褪为无色。这是因为氯气与水反应生成了盐酸和次氯酸:Cl2+H2O![]() HCl+HClO,溶液此时呈酸性使紫色石蕊溶液变红;因为生成的两种酸中有一种(次氯酸)具有漂白性,把石蕊这种有机色质漂白,溶液红色又褪去。
HCl+HClO,溶液此时呈酸性使紫色石蕊溶液变红;因为生成的两种酸中有一种(次氯酸)具有漂白性,把石蕊这种有机色质漂白,溶液红色又褪去。

 名校课堂系列答案
名校课堂系列答案