题目内容
(14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O22Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu-
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)=====CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)====2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+![]() O2(g)====H2O(l) △H3=-286kJ/mol
O2(g)====H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)====CuSO4(aq)+H2(g)的△H= 。
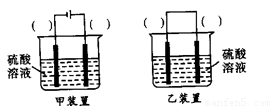
(3)欲实现反应Cu+H2SO2====CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)

(1)还原
(2)方法一
①取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②B
③CuO或Cu(OH)2(答案合理均给分)
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2O![]() Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
方法二:
+64kJ/mol
(3)
解析:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

 Au(NO3)3+3NO2↑+3H2O
Au(NO3)3+3NO2↑+3H2O [AuCl4]-
[AuCl4]-
 2Cu+SO2
2Cu+SO2