题目内容
3.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水.下列说法正确的是( )| A. | 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 | |
| B. | 元素X与元素Y能形成两种化学键类型完全相同的化合物 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR | |
| D. | 元素X、Z形成化合物的电子式可以表示成.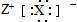 |
分析 X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一主族,则R为S元素,Z是短周期中金属性最强的金属元素,应为Na元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水,W应为Al元素,结合物质性质与元素周期律解答.
解答 解:X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一主族,则R为S元素,Z是短周期中金属性最强的金属元素,应为Na元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水,W应为Al元素,
A.元素Y、Z、W离子具有相同的电子层结构,因核电荷数越大离子半径越小,则离子半径逐渐减小,故A错误;
B.X为H,Y为O,可生成H2O、H2O2,二者化学键类型不完全相同,前者只含有O-H键,后者含有O-H、O-O键,故B错误;
C.非金属性O>S,元素的非进行越强,对应的氢化物越稳定,故C正确;
D.元素X、Z形成化合物为NaH,电子式可以表示成Na+[:H]-,故D错误.
故选C.
点评 本题考查结构与位置关系、元素周期律、微粒半径比较等,为高考常见题型,侧重于学生的分析能力的考查,难度中等,推断元素是关键,注意半径比较规律与基础知识掌握.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
13. Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
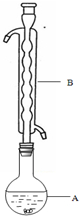
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
14.下列说法正确的是( )
| A. | 强酸的水溶液中不存在OH- | |
| B. | pH=0的溶液是酸性最强的溶液 | |
| C. | 在温度不变时,水溶液中c(H+)和c(OH-)不能同时减小 | |
| D. | 某温度下,纯水中c(H+)=2×10-7 mol•L-1,其呈酸性 |
18.14C具有放射性,它能自发放出某种射线,而衰变成其他元素.考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年.下列考古遗址发现的遗物中能用14C测定年代的是( )
| A. | 战国曾侯乙墓的青铜编钟(距今约2400年) | |
| B. | 马家窑文化遗址的粟(距今约5300年) | |
| C. | 秦始皇兵马俑(距今约2200年) | |
| D. | 元谋人的门齿(距今约170万年) |
8.依据一定的标准采取不同的分类方法是人们认识事物常用的方法.下列有关物质类别的判别标准中正确的是( )
| A. | 酸:能否与金属反应放出氢气 | B. | 电解质:水溶液是否导电 | ||
| C. | 离子化合物:是否含有离子键 | D. | 酸性氧化物:能否与碱反应 |
15.下列物质的类别与所含官能团不正确的是( )
| A. | 酚类-OH | B. | 羧酸-COOR | C. | 醛类-CHO | D. | 醚类 CH3-O-CH3 |
13.仪器名称为“容量瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
 ,⑦的结构式H-O-Cl.
,⑦的结构式H-O-Cl.