题目内容
(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为 。
。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式: 。
。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g)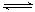 2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
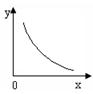
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
 丙+丁+水。
丙+丁+水。(1)若丙为NO2。①甲与乙反应的化学方程式为
 。
。②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:
 。
。(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+③SO2在一定条件下,发生:2SO2(g)+O2(g)
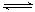 2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
(1)①C +4HNO3(浓)=CO2 +4 NO2 +2H2O
②N2H4(g) +O2(g)= N2(g)+ 2H2O(g) △H=-534kj.mol-1
(2)①蓝色晶体变白色粉末 ②2MnO4- +5SO2 +2H2O =2Mn2+ +5SO42- +4H+
③K=C2(SO3)/C2(S
 O2)*C(O2) C
O2)*C(O2) C 略

练习册系列答案
相关题目
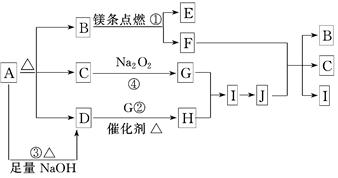
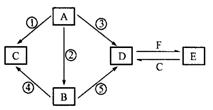
 状况下2.24 L G时,转移电子数为________ mol.
状况下2.24 L G时,转移电子数为________ mol. 合物E的反应。根据下列反应框图填空:
合物E的反应。根据下列反应框图填空: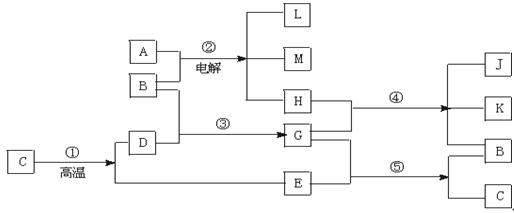
 与A含有相同元素的化合物,它们之间有如下转化关系:
与A含有相同元素的化合物,它们之间有如下转化关系:
 ______________
______________ 的化工原料,也是实验室常用的药品,C、D在一定的条件下可相互转化,F与A、B、C、D在一定的条件下均可发生反应,它们的部分转化关系如下图(部分反应物或生成物省略)。
的化工原料,也是实验室常用的药品,C、D在一定的条件下可相互转化,F与A、B、C、D在一定的条件下均可发生反应,它们的部分转化关系如下图(部分反应物或生成物省略)。