题目内容
5.下列离子方程式书写正确的是( )| A. | 向氯化铝溶液中通入过量氨气:4NH3+Al3++2H2O═AlO2-+4NH4+ | |
| B. | 将铝片打磨后置于NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
分析 A.氨水不会溶解氢氧化铝,反应生成的是氢氧化铝沉淀;
B.2mol铝完全反应生成3mol氢气,该反应不满足质量守恒定律、电子守恒;
C.氢氧化钡过量,铝离子完全转化成偏铝酸根离子;
D.二氧化碳过量,反应生成碳酸氢根离子.
解答 解:A.氯化铝溶液中加入过量的氨气,氢氧化铝不溶于氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3+3H2O═3NH4++Al(OH)3↓,故A错误;
B.将铝片打磨后置于NaOH溶液中,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.向明矾溶液中加入过量的Ba(OH)2溶液,反应生成硫酸钡沉淀、偏铝酸钠和水,反应的离子方程式为:Al3++2SO42-+Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故C正确;
D.通入过量的二氧化碳,反应生成氢氧化铝沉淀和碳酸氢钠,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确反应的实质是解题关键,解题时注意化学式的拆分、反应是否符合客观事实等角度分析,试题培养了学生的灵活运用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.根据下列操作及现象,所得结论不正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将pH=11的氨水稀释10倍,测得pH由11变成 10.6 | NH3•H2O?NH4++OH-的电离程度增大 |
| B | “NO2球”浸泡在热水中,颜色加深 | 2NO2(g)?N2O4(g)△H<0 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度: CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
16.向20mL 1mol•L-1 NaAlO2的溶液中逐渐加入浓度为4mol•L-1的盐酸溶液,若产生0.78g白色沉淀,则加入的盐酸溶液的体积可能为( )
| A. | 3 mL | B. | 2.5 mL | C. | 12.5 mL | D. | 17.5 mL |
13.下列说法正确的是( )
| A. | 可用25mL碱式滴定管量取20.00mLKMnO4溶液 | |
| B. | 读取滴定管内液体的体积抑视会导致读数偏大 | |
| C. | 做中和滴定实验时,用待测液润洗锥形瓶 | |
| D. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
20.根据如表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | K=3.5×10-4 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 | |
| HClO | K=3.2×10-8 |
| A. | 酸性强弱:KClO>H2CO3>HF | |
| B. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO${{\;}_{3}}^{2-}$+2HF═2F-+H2O+CO2↑ |
4.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0T1温度时,向密闭容器中通入N2O5,部分实验数据见下表
下列说法中不正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | T1温度下,前500s 以O2表示的反应速率为0.00148mol•L-1•s-1 | |
| B. | 平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则再平衡时c(N2O5)>5.00 mol•L-1 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | T1温度下,该反应达到平衡时N2O5的转化率为50% |
11.H2、NH3、HNO3、NH4NO3等都是重要的化工原料.
(1)工业上生产氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在t℃时,向1L密闭容器中充入0.2mol CO(g)和0.3molH2O(g).反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下CO的转化率为60%,反应的平衡常数K=1
(2)工业上合成NH3的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).工业实际生产中需通入过量的空气,其目的是增大氢气利用率
(3)NH4NO3溶液呈酸性(填“酸性”、“碱性”或“中性”),其原因是:NH4++H2O?NH3.H2O+H+(用离子方程式表示)
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol;
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol.
则CH4直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(1)工业上生产氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在t℃时,向1L密闭容器中充入0.2mol CO(g)和0.3molH2O(g).反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下CO的转化率为60%,反应的平衡常数K=1
(2)工业上合成NH3的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).工业实际生产中需通入过量的空气,其目的是增大氢气利用率
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol;
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol.
则CH4直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
8.硝酸具有强氧化性,甲乙两组同学对硝酸的性质进行研究.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
请回答:
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:
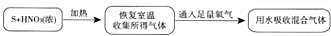
a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.
(1)甲组同学进行了铜与浓硝酸、稀硝酸反应的实验:
| 实验组 | 实验操作 | 实验现象 |
| 实验1 | 在 I、II两支试管中分别加入等体积的浓硝酸和稀硝酸,再向两支试管中分别放入等质量的铜片. | 铜均无剩余,试管 I中溶液呈绿色;试管 II中溶液呈蓝色. |
| 实验2 | 分别取实验 I中的绿色溶液于 III、IV两试管中,对试管 III进行加热,向试管 IV中缓慢加入水,并不停振荡. |
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O.
②实验I能否说明溶液呈现不同颜色与硝酸铜的物质的量浓度无关?能(填“能”或“不能”),原因是两份溶液中硝酸铜的物质的量浓度相等.
③根据实验结果推测,铜与浓硝酸反应后溶液呈绿色的原因可能是反应生成的红棕色气体溶于生成的蓝色硝酸铜溶液.
④请另设计一个方案,验证你所得到的上述结论:方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色.
(2)乙组同学用足量浓硝酸和硫单质反应进行了实验探究.
假设硝酸的还原产物只有一种,乙组同学根据氧化还原反应推测硫的氧化产物,提出三种可能:I.只有硫酸;Ⅱ.只有二氧化硫;Ⅲ.二氧化硫和硫酸
乙组同学设计了下列实验,实验流程及步骤:

a.混合气体用水吸收后,测得无含硫、含氮物质逸出,并将吸收后的液体配成100.00mL溶液;
b.取a中所得溶液20.00mL,加入足量氯化钡溶液,得到0.466g白色沉淀;
c.再取20.00mLa中所得溶液,用氢氧化钠溶液中和,恰好用去0.6mol/L氢氧化钠溶液30.00mL.
请回答:
①二氧化氮和氧气的混合气体被水完全吸收的化学方程式为4NO2+O2+2H2O═4HNO3.
②步骤a中配制的100.00mL溶液中H+的物质的量浓度是0.9mol/L.
③该实验中收集到气体中含有NO2和SO2,假设III(填“I”“II”或“III”)成立.
④该实验中浓硝酸和硫反应的化学方程式为14HNO3(浓)+3S$\frac{\underline{\;△\;}}{\;}$2SO2↑+H2SO4+14NO2↑+6H2O.
9.0.2molCH4的质量为( )
| A. | 1.6g | B. | 3.2g | C. | 5.6g | D. | 8g |