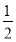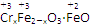题目内容
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):
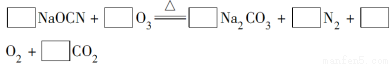
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
(1)-285.0 kJ·mol-1
(2)2 3 1 1 3 1
(3)3O2+6H++6e-=3H2O2(或O2+2H++2e-=H2O2)
(4)2I-+O3+H2O=2OH-+I2+O2
【解析】(1)由盖斯定律可得2O3(g)=3O2(g)
ΔH=-285.0 kJ·mol-1。(2)O3~2e-~O2-,2NaOCN~6e-~N2,根据得失电子守恒有2NaOCN~6e-~3O3,再根据原子守恒配平即可。(3)阴极发生还原反应,在酸性条件下,氧气得电子结合氢离子形成H2O2。(4)根据生成两种单质可知,O3将KI氧化为I2,同时O3被还原为O2,由O3~2e-~O2-,2KI~2e-~I2,可得2KI~2e-~O3,再根据原子守恒配平即可。