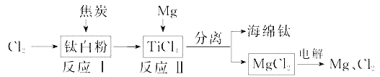
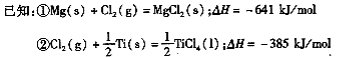��Ŀ����
����Ŀ���������ƽ��ȶ����������Ҵ�������ˮ�������ᣬ���������Լ���ҽ�÷���������������������һ���Ʊ��������Ƶ�ʵ�鷽����
�ش��������⣺
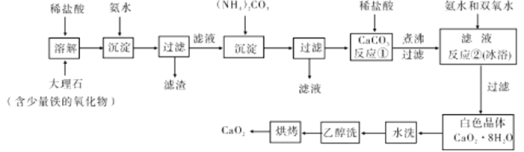
��1������ʯ�����ܽ⡢���������ˡ��ڳ������ٹ��ˣ��õ�CaCO3����Ŀ���� ��������Ҫ�õ��IJ���������Ҫ��©�����ձ��� ��
��2����Ӧ�ٵľ��������Ϊ��μ���ϡ���ᣬ����Һ���д����������塣����Һ��У����ȹ��ˡ�����Һ��е������� ��
��3����Ӧ�ڵĻ�ѧ����ʽΪ ���÷�Ӧ��Ҫ�ڱ�ԡ�½��У�ԭ���� ��
��4����ɫ����ˮϴʱ���ж��Ƿ�ϴ���ķ����� ��ʹ������ϴ�ӵ�Ŀ���� ��
��5���Ʊ��������Ƶ���һ�ַ����ǣ���ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ���÷����ŵ��ǹ��ռ����������ò�Ʒ��ȱ���� ��
��6��CaO2��8H2O������ˮ�Ĺ�����,�費��ͨ��������Ŀ�������ƹ������Ʒֽ⡣��ͨ��������л��ж�����̼�������� ����֪CaO2��350��Ѹ�ٷֽ�����CaO��O2����ͼ��ʵ���Ҳⶨ��Ʒ��CaO2������װ�ã��г�װ��ʡ�ԣ���
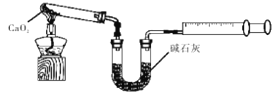
����ȡ��Ʒ����Ϊag�����������������ΪVmL���ѻ���ɱ�״���������Ʒ��CaO2����������Ϊ ���ú�a��V��ʽ�ӱ�ʾ����
���𰸡���1����ȥ���ʣ��õ�������̼��ƣ����ᴿ̼��ƣ�(2��) ������
��2����ȥ��Һ���ܽ��CO2
��3��CaCl2+H2O2+2NH3H2O+6H2O �TCaO28H2O��+2NH4Cl��CaCl2��2NH3��H2O��H2O2=CaO2��2NH4Cl��2H2O(2��) �¶ȹ���ʱ��������ֽ�
��4��ȡ����ĩ��ˮϴҺ���Թ��У��μ�ϡ�����ữ���ٵμ�AgNO3 ��Һ(2��)
ȥ����������ˮ��
��5�����Ƚϵ�
��6��������̼��������Ʒ�Ӧ����̼��� ![]()
��������
�����������1������ʯ�����ܽ⡢���������ˡ��ڳ������ٹ��ˣ��õ�CaCO3����Ŀ���dz�ȥ���ʣ��õ�������̼��ƣ�������Ҫ�õ��IJ���������Ҫ��©�����ձ�����������
��2����Ӧ���ľ��������Ϊ��μ���ϡ��������CO2��CO2���백ˮ��Ӧ�����Խ���Һ��е���������ȥ��Һ���ܽ��CO2��
(3������ԭ���غ��֪��Ӧ�ڵĻ�ѧ����ʽΪCaCl2+H2O2+2NH3H2O+6H2O �TCaO28H2O��+2NH4Cl�������¶ȹ���ʱ��������ֽ��������÷�Ӧ��Ҫ�ڱ�ԡ�½��С�
(4����Һ�к��������ӣ�����ɫ����ˮϴʱ�ж��Ƿ�ϴ���ķ�������ͨ�����������ӣ��������ȡ����ĩ��ˮϴҺ���Թ��У��μ�ϡ�����ữ���ٵμ�AgNO3 ��Һ���������Ʋ������Ҵ�������ˮ�����ʹ���Ҵ�ϴ�ӵ�Ŀ����ȥ����������ˮ����
��5���Ʊ��������Ƶ���һ�ַ����ǣ���ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ������̼��Ʋ�����ˮ���������ò�Ʒ��ȱ�������Ƚϵ���
��6��CO2�����������������ͨ��������л��ж�����̼��������������̼��������Ʒ�Ӧ����̼��������������ʵ�����![]() �����ݷ���ʽ2CaO2��2CaO+O2����֪CaO2�����ʵ�����
�����ݷ���ʽ2CaO2��2CaO+O2����֪CaO2�����ʵ�����![]() ��������
��������![]() �������Ʒ��CaO2����������Ϊ
�������Ʒ��CaO2����������Ϊ![]() ��
��

����Ŀ��I��ijѧ����0.2000 mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
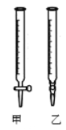
��������ˮϴ�Ӽ�ʽ�ζ�������ע��NaOH��Һ����0���̶�������
���̶��õζ��ܲ�ʹ�ζ��ܼ������Һ��
������Һ������0����0���̶������£������¶���
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ
���ñ�Һ�ζ����յ㣬���µζ���Һ�����
��ش�
��1�����ϲ����д������ǣ����ţ� ��
��2���ñ�NaOH��Һ�ζ�ʱ��Ӧ����NaOH��Һע��______��������ͼ��ѡ��ס����ҡ���
��3�����в���������ʵ����ƫ����ǣ�______�����ţ�
A������ƿװҺǰ��������������ˮ
B���ζ�ǰ���ζ��ܼ��������ݣ��ζ���������
C����ƿ��������ˮϴ�Ӻ�δ�ô���Һ��ϴ
D������ʽ�ζ�����ȡҺ��ʱ���ͷ�Һ��ǰ�ζ���ǰ�������ݣ�֮����ʧ
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע�� ���жϵ���ζ��յ�������ǣ���ƿ����Һ ��
��5��������ʵ�����ݼ�¼��
�ζ����� | �������mL | NaOH��Һ���������mL�� | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
ͨ������ɵã�������Ũ��Ϊ��______ molL-1������������4λС����
II�����ü�����ζ����ɲⶨBa2���ĺ�����ʵ����������С�
��֪��2CrO42����2H����Cr2O72����H2O Ba2����CrO42����BaCrO4��
����1����ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
����2����ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽��:1��ͬŨ�ȵ�Na2CrO4��Һ����Ba2����ȫ�������ټ������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ���������ΪV1 mL��
��BaCl2��ҺŨ��Ϊ______________________ mol��L��1��������2�еμ�����ʱ����������Һ��������Ba2��Ũ�ȵIJ���ֵ��___________���ƫ��ƫС������