题目内容
12.(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1.则燃烧1molH2放出的热量为286kJ.(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放632kJ的能量.
分析 (1)由氢气的热值可知,1gH2燃烧放出的热量为143kJ,然后根据能量与物质的质量成正比来计算;
(2)根据反应热=反应物的总键能-生物物的总键能来解答.
解答 解:(1)由氢气的热值可知,1gH2燃烧放出的热量为143kJ,然后根据能量与物质的物质的量成正比;则1mol(即2g)H2放出的热量为:2×143kJ=286kJ;
故答案为:286;
(2)设1molNO分子中的化学键形成时可释放xkJ的能量,反应N2+O2?2NO中反应热=反应物的总键能-生物物的总键能=946kJ/mol+498kJ/mol-xkJ/mol×2=180kJ/mol;
解得:x=632,故答案为:632.
点评 本题主要考查热值的运用、反应热的计算,本题难度中等,注意掌握从化学键的角度计算反应热的方法.

练习册系列答案
相关题目
16.等物质的量的下列物质与足量稀硝酸反应,氧化产物伪Cu2-或SO42-还原产物为N0,消耗硝酸的量最多的是( )
| A. | Cu | B. | Cu2O | C. | CuS | D. | Cu2S |
3.下列各组物质中,互为同系物的是( )
| A. | CH3-CH=CH2和 | B. | 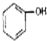 和 和 | C. |  和 和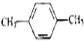 | D. | 乙酸和油酸 |
20.请回答:
Ⅰ:C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族.
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子.
(3)用“>”或“<”填空:
Ⅱ:
(4)H2O2的电子式 .
.
(5)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(6)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式AgCl(s)+Br-═AgBr(s)+Cl-.
(7)完成以下氧化还原反应的离子方程式:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
Ⅰ:C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族.
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子.
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
(4)H2O2的电子式
 .
.(5)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(6)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式AgCl(s)+Br-═AgBr(s)+Cl-.
(7)完成以下氧化还原反应的离子方程式:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
7.NA代表阿伏加德罗常数.下列有关NA的叙述中,正确的是( )
| A. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA | |
| B. | 14g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 1mol任何物质所含的分子数均为NA |
17.下列有关物质的性质或应用的说法不正确的是( )
| A. | 石油裂化可获得乙烯、丙烯和丁二烯 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | 二氧化硅是生产光纤制品的基本原料 |
2.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 1 mol C3H8分子中共价键总数为8 NA | |
| C. | 过氧化钠与水反应时,生成0.1mol O2转移的电子数为0.2NA | |
| D. | 密闭容器中2mol SO2与1mol O2充分反应,产物的分子数为2NA |
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快. ;
;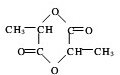 +2H2O;
+2H2O;