题目内容
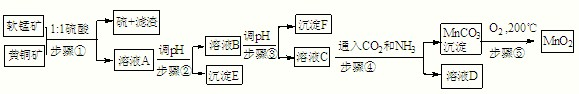
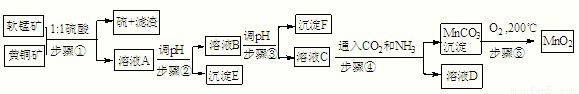
采用硫酸同槽浸出软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)的新工艺方法提取锰、铜、铁元素获得成功,符合绿色化学思想,生产流程示意如下:已知:
步骤①:5MnO2+2CuFeS2+10H2SO4=5MnSO4+Fe2(SO4)3+2CuSO4+4S+10H2O
(1)请写出MnO2一种用途:______.
根据下表数据,回答相关问题.
(2)E:______,F:______,D中主要溶质______(填化学式).
(3)若c(MnSO4)=3×10-6 mol?L-1,c(CO32-)=3.3×10-5 mol?L-1,则MnSO4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO3的Ksp=______.
(4)请写出步骤④发生的离子反应方程式:______.
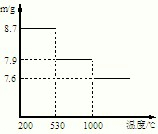
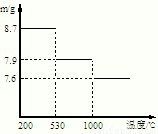
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.
(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L-1 Na2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液.反应式如下:MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O
①写出酸性KMnO4溶液滴定剩余Na2C2O4溶液的离子反应方程式:______.
②计算软锰矿中MnO2的百分含量______.

步骤①:5MnO2+2CuFeS2+10H2SO4=5MnSO4+Fe2(SO4)3+2CuSO4+4S+10H2O
(1)请写出MnO2一种用途:______.
根据下表数据,回答相关问题.
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(3)若c(MnSO4)=3×10-6 mol?L-1,c(CO32-)=3.3×10-5 mol?L-1,则MnSO4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO3的Ksp=______.
(4)请写出步骤④发生的离子反应方程式:______.
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.

(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L-1 Na2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液.反应式如下:MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O
①写出酸性KMnO4溶液滴定剩余Na2C2O4溶液的离子反应方程式:______.
②计算软锰矿中MnO2的百分含量______.
(1)在所学知识中,二氧化锰的作用有:在双氧水的分解反应中做催化剂,在实验室可以用二氧化锰和浓盐酸反应制取氯气,故答案为:催化剂、制备氯气;
(2)根据表中数据,氢氧化铁在pH=6.4开始沉淀,当pH=9.0时沉淀完全,氢氧化铜在pH=4.2开始沉淀,当pH=6.7时沉淀完全,所以步骤②先获得的是氢氧化铁,然后获得的是氢氧化铜,最后溶液是硫酸铵,
故答案为:Fe(OH)3、Cu(OH)2、(NH4)2SO4;
(3)MnCO3的Ksp=[Mn2+]?[CO32-]=
×
=2.2×10-11,故答案为:2.2×10-11;
(4)向含有锰离的盐中通入二氧化碳和氨气,可以获得碳酸锰沉淀,原理为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+,
故答案为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)530℃是获得的是8.7g的二氧化锰,物质的量是0.1mol,在1000℃是得到的是7.9gMn的氧化物,相对分子质量=
=79或是79的整数倍,所以是Mn2O3,故答案为:Mn2O3;
(6)①高锰酸钾具有强氧化性,可以将草酸根氧化,实质是:C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
②0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液,则草酸钠的剩余量=0.1000mol?L-1×0.004L×
=0.001mol,所以反应掉的草酸钠的量是0.001mol,根据反应MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O,
0.001mol Na2C2O4溶液消耗掉的二氧化锰的物质的量为0.001mol,所以软锰矿中MnO2的百分含量=
×100%=20.0%,故答案为:20%.
(2)根据表中数据,氢氧化铁在pH=6.4开始沉淀,当pH=9.0时沉淀完全,氢氧化铜在pH=4.2开始沉淀,当pH=6.7时沉淀完全,所以步骤②先获得的是氢氧化铁,然后获得的是氢氧化铜,最后溶液是硫酸铵,
故答案为:Fe(OH)3、Cu(OH)2、(NH4)2SO4;
(3)MnCO3的Ksp=[Mn2+]?[CO32-]=
| 3×10-6×2 |
| 3 |
| 3.3×10-5 |
| 3 |
(4)向含有锰离的盐中通入二氧化碳和氨气,可以获得碳酸锰沉淀,原理为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+,
故答案为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)530℃是获得的是8.7g的二氧化锰,物质的量是0.1mol,在1000℃是得到的是7.9gMn的氧化物,相对分子质量=
| 7.9 |
| 0.1 |
(6)①高锰酸钾具有强氧化性,可以将草酸根氧化,实质是:C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
②0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液,则草酸钠的剩余量=0.1000mol?L-1×0.004L×
| 5 |
| 2 |
0.001mol Na2C2O4溶液消耗掉的二氧化锰的物质的量为0.001mol,所以软锰矿中MnO2的百分含量=
| 0.001mol×87g/mol |
| 0.435g |

练习册系列答案
相关题目
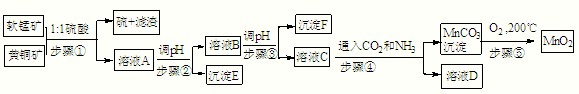
采用硫酸同槽浸出软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)的新工艺方法提取锰、铜、铁元素获得成功,符合绿色化学思想,生产流程示意如下:已知:
步骤①:5MnO2+2CuFeS2+10H2SO4=5MnSO4+Fe2(SO4)3+2CuSO4+4S+10H2O
(1)请写出MnO2一种用途:______.
根据下表数据,回答相关问题.
(2)E:______,F:______,D中主要溶质______(填化学式).
(3)若c(MnSO4)=3×10-6 mol?L-1,c(CO32-)=3.3×10-5 mol?L-1,则MnSO4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO3的Ksp=______.
(4)请写出步骤④发生的离子反应方程式:______.
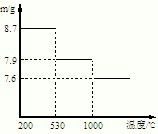
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.
(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L-1 Na2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液.反应式如下:MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O
①写出酸性KMnO4溶液滴定剩余Na2C2O4溶液的离子反应方程式:______.
②计算软锰矿中MnO2的百分含量______.

步骤①:5MnO2+2CuFeS2+10H2SO4=5MnSO4+Fe2(SO4)3+2CuSO4+4S+10H2O
(1)请写出MnO2一种用途:______.
根据下表数据,回答相关问题.
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(3)若c(MnSO4)=3×10-6 mol?L-1,c(CO32-)=3.3×10-5 mol?L-1,则MnSO4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO3的Ksp=______.
(4)请写出步骤④发生的离子反应方程式:______.
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.

(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L-1 Na2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液.反应式如下:MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O
①写出酸性KMnO4溶液滴定剩余Na2C2O4溶液的离子反应方程式:______.
②计算软锰矿中MnO2的百分含量______.