题目内容
【题目】(1)写出下列各烷烃的分子式。
①烷烃A在同温同压下,蒸气密度是H2的43倍,则A为 。
②1 L烷烃C的蒸气完全燃烧时,生成同温同压下15 L的水蒸气,则C为___________。
③烷烃D分子中含有22条共价键,则D为_____________。
(2)相对分子质量为72的烷烃,若此有机物的一氯代物分子中有两个—CH3,两个—CH2—,一个![]() 和一个—Cl,它的可能结构有种 。
和一个—Cl,它的可能结构有种 。
【答案】(1)①C6H14 ②C14H30 ③C7H16(2)4(2分)
【解析】
试题分析:(1)①烷烃A在同温同压下,蒸气密度是H2的43倍,则A的相对分子质量是86,则根据烷烃的通式CnH2n+2可知n=(86-2)÷14=6,所以分子式为C6H14。
②1 L烷烃C的蒸气完全燃烧时,生成同温同压下15 L的水蒸气,则根据原子守恒可知氢原子的个数是30,则根据烷烃的通式可知2n+2=30,解得n=14,则C的分子式为C14H30。
③烷烃D分子中含有22条共价键,则根据烷烃的通式可知2n+2+n-1=22,解得n=7,因此D的分子式为C7H16。
(2)相对分子质量为72的烷烃的分子式为C5H12,若此有机物的一氯代物分子中有两个—CH3,两个—CH2—,一个![]() 和一个—Cl,它的可能结构有CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3,CH3CH(CH3)CH2CH2Cl,CH2ClCH(CH3)CH2CH3,共计4种。
和一个—Cl,它的可能结构有CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3,CH3CH(CH3)CH2CH2Cl,CH2ClCH(CH3)CH2CH3,共计4种。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1) 据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正__________v逆(填“>”、“=”或“<”)。
(2) 对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
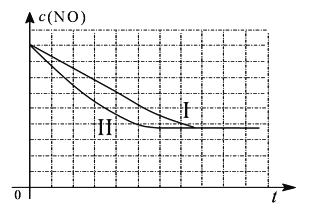
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10-3 | 4.50×10- 4 | 2.50×10- 4 | 1.50×10- 4 | 1.00×10- 4 | 1.00×10- 4 |
c(CO)(mol/L) | 3.60×10- 3 | 3.05×10- 3 | 2.85×10- 3 | 2.75×10- 3 | 2.70×10- 3 | 2.70×10- 3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)= ,CO的平衡转化率为____________。(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式________________。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
①以上三组实验的实验目的是_______________________。
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图。