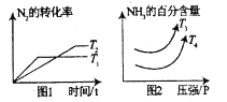
题目内容
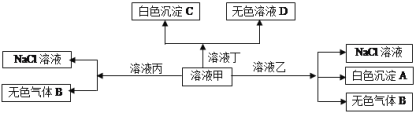
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
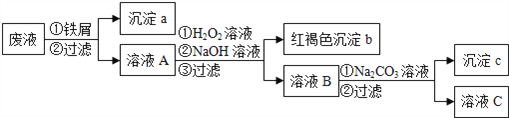
请回答:
(1)沉淀a中含有的单质是_________;
(2)沉淀b的化学式是__________;
(3)沉淀c的化学式是__________;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_______________。
【答案】 Cu、Fe Fe(OH)3 BaCO3 2Fe2++H2O2+2H+===2Fe3++2H2O
【解析】酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3↓,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+。
(1)由以上分析可知沉淀a中含有的单质是Fe、Cu,故答案为:Fe、Cu;(2)由以上分析可知红褐色沉淀为Fe(OH)3↓,故答案为:Fe(OH)3;(3)由分析可知沉淀c为BaCO3,故答案为:BaCO3;(4)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目