题目内容
【题目】钼酸钠晶体(Na2MoO4·2H2O)可用于制造生物碱、油墨、化肥、钼红颜料、催化剂等,也可用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
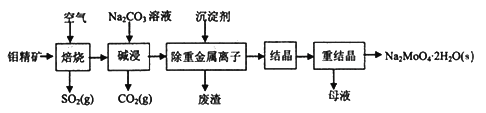
回答下列问题:
(1)Na2MoO4中Mo的化合价为____________。
(2)“焙烧”时,Mo元素转化为MoO3,反应的化学方程式为____________,氧化产物是________(写化学式)。
(3)“碱浸”生成CO2和另外一种物质,CO2的电子式为_______,另外一种生成物的化学式为______。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,SO42-的去除率为______%。(小数点后保留一位数字)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
【答案】 +6 2MoS2 +7O2![]() 2MoO3 +4SO2 MoO3、SO2
2MoO3 +4SO2 MoO3、SO2 ![]() Na2MoO4 PbS 97.3 MoS2+9ClO+6OH
Na2MoO4 PbS 97.3 MoS2+9ClO+6OH![]() +9Cl+2
+9Cl+2![]() +3H2O
+3H2O
【解析】灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2![]() 2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4·2H2O,据此解答。
2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4·2H2O,据此解答。
(1)Na2MoO4中Na是+1价,O是-2价,则根据正负价代数和为0可知Mo的化合价为+6价;(2)“焙烧”时,Mo元素转化为MoO3,S转化为SO2,所以反应的化学方程式为2MoS2 +7O2![]() 2MoO3 +4SO2,反应中Mo、S元素化合价升高,所以氧化产物是MoO3、SO2;(3)“碱浸”生成CO2和另外一种物质,根据原子守恒可知另外一种生成物的化学式为Na2MoO4,CO2是共价化合物,电子式为
2MoO3 +4SO2,反应中Mo、S元素化合价升高,所以氧化产物是MoO3、SO2;(3)“碱浸”生成CO2和另外一种物质,根据原子守恒可知另外一种生成物的化学式为Na2MoO4,CO2是共价化合物,电子式为![]() ;(4)若“除重金属离子”时加入的沉淀剂为Na2S,重金属离子是铅离子,则废渣成分的化学式为PbS;(5)当BaMoO4开始沉淀时,溶液中的硫酸根浓度是
;(4)若“除重金属离子”时加入的沉淀剂为Na2S,重金属离子是铅离子,则废渣成分的化学式为PbS;(5)当BaMoO4开始沉淀时,溶液中的硫酸根浓度是![]() ,所以SO42-的去除率是
,所以SO42-的去除率是![]() ;(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,根据原子守恒和得失电子守恒可知该反应的离子方程式为MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O。
;(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,根据原子守恒和得失电子守恒可知该反应的离子方程式为MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O。