题目内容
下列各组元素性质递变情况错误的是( )。
A.H、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
C
解析

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
不能说明X的电负性比Y的电负性大的是( )。
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
关于原子模型的演变过程,正确的是( )。
| A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
| B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型 |
| C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型 |
| D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
X、Y和Z是短周期的三种元素,已知X元素原子的最外层只有一个电子,Y元素原子M层上的电子数是K层和L层电子总数的一半,Z元素原子L层上的电子数比Y元素原子L层上电子数少2个,则这三种元素所组成的化合物的化学式不可能是( )。
| A.X2YZ4 | B.XYZ3 | C.X3YZ4 | D.X4Y2Z7 |
下列说法中正确的是( )。
| A.在周期表中金属与非金属的分界处可以找半导体材料 |
| B.H2S、H2Se、HF的热稳定性依次增强 |
| C.NaOH、KOH、Mg(OH)2的碱性依次减弱 |
| D.Cl、S、N元素的非金属性依次增强 |
某粒子结构示意图为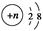 ,若该粒子为离子,则它所带的电荷数可能为( )。
,若该粒子为离子,则它所带的电荷数可能为( )。
①8-n ②n-8 ③10-n ④n-10
| A.①② | B.①③ | C.③④ | D.②④ |
核电荷数大于10的某短周期元素,其原子最外电子层所含有的电子数是次外层所含有的电子数的一半,有关该元素的单质或化合物的描述不正确的是( )。
| A.该元素在第3周期第ⅣA族 |
| B.该元素的单质在常温下性质稳定,不易与水反应 |
| C.该元素的氧化物不与酸反应,可与强碱的水溶液反应 |
| D.该元素在地壳中的含量大,居所有元素的第二位 |
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )。
| A.钡可从氯化钠溶液中置换出金属钠 |
| B.钡可从冷水中置换出氢气 |
| C.钡可从硫酸铜溶液中置换出铜 |
| D.在溶液中Ba2+可氧化金属锌,生成Zn2+ |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是( )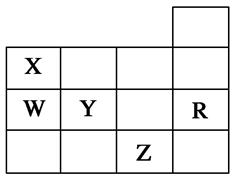
| A.常压下五种元素的单质中Z单质的沸点最低 |
| B.Y、Z阴离子电子层结构都与R原子相同 |
| C.W的原子半径比X的小 |
| D.Y元素的非金属性比W元素的非金属性强 |