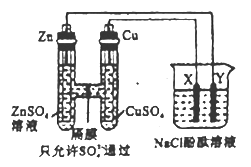
题目内容
【题目】下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同。据此回答:

(1)a电极的电极材料是_______(填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为____________。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是____________。

(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为_________极,d电极上发生反应的电极反应式为________。
【答案】 PbO2 2H2O![]() 2H2↑+O2↑ 0.1molCu(OH)2或0.1molCuO、0.1molH2O 负 O2+4H++4e-=2H2O
2H2↑+O2↑ 0.1molCu(OH)2或0.1molCuO、0.1molH2O 负 O2+4H++4e-=2H2O
【解析】甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现g电极附近的溶液变红,说明g电极是电解池的阴极,h是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现g电极附近的溶液变红,说明g电极是电解池的阴极,h是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
(1)a电极是铅蓄电池的正极,正极的电极材料是PbO2;(2)丙中电解硫酸铝,其实际上是电解水,其电解方程式为2H2O![]() 2H2↑+O2↑;(3)c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,设生成的氧气为xmol,则氢气也为xmol,生成的Cu为0.1L×1mol/L=0.1mol,由得失电子可得:2x+0.1×2=4x,解得x=0.1mol,则电解时生成0.1mol氢气、0.1mol氧气和0.1molCu,若要恢复到原来的状态,需要加入0.1molCu(OH)2;(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,c为负极,氧气在d极得电子,正极的反应为O2+4H++4e-=2H2O。
2H2↑+O2↑;(3)c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,设生成的氧气为xmol,则氢气也为xmol,生成的Cu为0.1L×1mol/L=0.1mol,由得失电子可得:2x+0.1×2=4x,解得x=0.1mol,则电解时生成0.1mol氢气、0.1mol氧气和0.1molCu,若要恢复到原来的状态,需要加入0.1molCu(OH)2;(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,c为负极,氧气在d极得电子,正极的反应为O2+4H++4e-=2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案