题目内容
常温下,对于1L0.005mol·L-1硫酸表述中正确的是
| A.由水电离出的c(H+)=1.0×10-12mol·L-1 |
| B.加水稀释后,溶液中所有离子的浓度均减少 |
| C.2c(H+)= c(SO42-)+ c(OH-) |
| D.滴加稀氨水使pH=7,则c(NH4+)=" 2" c(SO42-) |
AD
试题分析:硫酸是强酸,能完全电离,则H2SO4=2H++SO42—中氢离子浓度与硫酸浓度之比等于系数之比,即c(H+)=0.005mol·L-1×2 =0.01mol/L,由于水是极弱电解质,硫酸能抑制水的电离,水电离出的氢离子可忽略不计,则溶液中c(H+)=0.01mol/L,由于常温下水的离子积为1.0×10-14,则溶液中c(OH-)=Kw/ c(H+)=1.0×10-12 mol/L,由于溶质不能电离出氢氧根离子,氢氧根离子全部来自水的电离,则水电离出c(OH-)= 1.0×10-12 mol/L,由于H2O
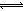 H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
练习册系列答案
相关题目

