题目内容
X、Y、Z三种气体,当X和Y按1∶2的物质的量之比混合并通入密闭容器进行反应:X+2Y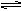 2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
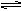 2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( ) | A.70% | B.60% | C.50% | D.40% |
B
设X和Y的物质的量分别为1mol、2mol,X转化的物质的量为x,则
X + 2Y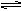 2Z
2Z
初始物质的量/mol: 1 2 0
转化物质的量/mol: x 2x 2x
平衡物质的量/mol: 1—x 2—2x 2x
依题意,可得: (1—x)+(2—2x)= 2x
解之,得:x=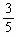 mol
mol
则x的转化率是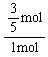 ×100%=60%。
×100%=60%。
X + 2Y
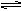 2Z
2Z初始物质的量/mol: 1 2 0
转化物质的量/mol: x 2x 2x
平衡物质的量/mol: 1—x 2—2x 2x
依题意,可得: (1—x)+(2—2x)= 2x
解之,得:x=
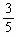 mol
mol则x的转化率是
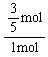 ×100%=60%。
×100%=60%。
练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
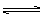 cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是
cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是 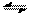 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)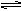 PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )
PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )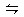 xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( )
xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( ) 3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )
3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( ) I2(g)+H2(g),增大压强可使平衡体系颜色变深
I2(g)+H2(g),增大压强可使平衡体系颜色变深