题目内容
(16分)对于甲、乙、丙、丁、戊五种溶液有如下信息:
①分别NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)。
②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性。
③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
请回答下列问题:
⑴用化学式表示出各物质:乙 、丁 。
⑵请用离子方程式表示戊溶液呈酸性的原因: 。
⑶请用离子方程式表示甲与乙的反应: 。
⑷检验甲溶液中甲的阴离子的方法是先加 试剂,再加 试剂,观察到
现象,证明该阴离子存在。
⑸若丙、丁形成的白色沉淀的溶度积常数Ksp=1.8×10-20,则将1 L 1mol/L的丙溶液与1 L 1 mol/L的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离子的浓度约为 mol/L。
①分别NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)。
②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性。
③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
请回答下列问题:
⑴用化学式表示出各物质:乙 、丁 。
⑵请用离子方程式表示戊溶液呈酸性的原因: 。
⑶请用离子方程式表示甲与乙的反应: 。
⑷检验甲溶液中甲的阴离子的方法是先加 试剂,再加 试剂,观察到
现象,证明该阴离子存在。
⑸若丙、丁形成的白色沉淀的溶度积常数Ksp=1.8×10-20,则将1 L 1mol/L的丙溶液与1 L 1 mol/L的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离子的浓度约为 mol/L。
(1)Na2CO3、 BaCl2 (2)NH4++H2O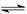 NH3·H2O+H+
NH3·H2O+H+
(3)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ (4)足量的盐酸, BaCl2,白色沉淀(5)3.6×10-20mol·L-1
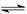 NH3·H2O+H+
NH3·H2O+H+(3)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ (4)足量的盐酸, BaCl2,白色沉淀(5)3.6×10-20mol·L-1
由于Ag+只能和NO3-共存,所以一定有硝酸银;根据③可知,产生得白色沉淀是氢氧化铝,气体是CO2,所以再根据②可知,乙是碳酸钠,甲中含有Al3+;又因为丁可分别与甲、乙、丙反应生成白色沉淀,又因为丁显中性,所以丁是氯化钡,则甲是硫酸铝,丙是硝酸银,因此戊是氯化铵。
(1)略
(2)氯化铵是强酸弱碱盐,NH4+水解显酸性,方程式为NH4++H2O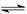 NH3·H2O+H+。
NH3·H2O+H+。
(3)铝离子水解显酸性,CO32-水解显碱性,二者相互促进,所以方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(4)检验SO42-时,首先要加入盐酸,以排除CO32-等干扰,然后再加入氯化钡溶液,如果出现白色沉淀,说明含有SO42-。
(5)根据方程式BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2可知,氯化钡是过量的,反应后溶液中氯离子浓度是(2mol-1mol)÷2L=0.5mol/L,所以根据溶度积常数的表达式可知,Ag+浓度是1.8×10-20÷0.5=3.6×10-20mol·L-1。
(1)略
(2)氯化铵是强酸弱碱盐,NH4+水解显酸性,方程式为NH4++H2O
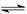 NH3·H2O+H+。
NH3·H2O+H+。(3)铝离子水解显酸性,CO32-水解显碱性,二者相互促进,所以方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(4)检验SO42-时,首先要加入盐酸,以排除CO32-等干扰,然后再加入氯化钡溶液,如果出现白色沉淀,说明含有SO42-。
(5)根据方程式BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2可知,氯化钡是过量的,反应后溶液中氯离子浓度是(2mol-1mol)÷2L=0.5mol/L,所以根据溶度积常数的表达式可知,Ag+浓度是1.8×10-20÷0.5=3.6×10-20mol·L-1。

练习册系列答案
相关题目
 ; OT:HC
; OT:HC ; RU:Cl-
; RU:Cl-