题目内容
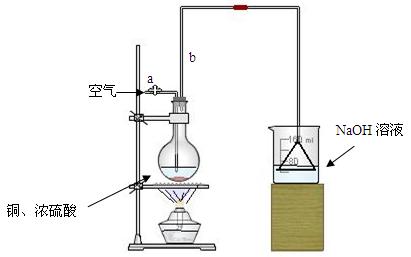
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3 C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2
(1)3Fe + 4H2O(g)  或
或 Fe3O4
+ 4H2 (2分) (2)A,C(2分)
Fe3O4
+ 4H2 (2分) (2)A,C(2分)
(3)Fe + 2Fe3+= 3Fe2+(2分)(出现此方程式才给分,只写Fe3O4 + 8H+= Fe2+ +2Fe3+ +4 H2O不给分)
(4)FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 (2分) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (2分)
(5)还原(1分),Fe2+易被空气中的氧气氧化而变质(1分),铁粉(1分)
(6)把蒸馏水煮沸(1分),利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,防止Fe(OH)2被空气中氧气氧化(2分),B(1分)。
【解析】
试题分析:1)硬质试管中发生反应是铁与水蒸气的反应,注意铁只能生成四氧化三铁和氢气,不能写出三氧化二铁;
(2)若溶液变红色则说明溶液中有三价铁离子,不能排除溶液中是否有亚铁离子,所以硬质试管中固体物质的成分一定有Fe3O4,可能有Fe,若溶液未变红色则说明溶液中无三价铁离子,则一定有过量的铁把三价铁还原为二价铁离子,硬质试管中固体物质的成分一定有Fe3O4和Fe。
(3)说明过量的铁把三价铁还原为二价铁,Fe + 2Fe3+= 3Fe2+。
(4)生成白色沉淀是氢氧化亚铁,迅速变成灰绿色,最后变成红褐色是氢氧化亚铁被氧气氧化为氢氧化铁, FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4, 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
(5)未变红的溶液变成红色,Fe2+ 被氧化为三价铁离子,说明具有还原性。实验室中含Fe2+的盐溶液需现用现配制的原因是易被空气中的氧气氧化而变质,并且配制含Fe2+的盐溶液时应加入少量铁粉,可以把氧化后的三价铁再还原成亚铁离子。
(6)获得不含O2的蒸馏水的方法一般是煮沸溶液,赶走气体。反应开始时,打开止水夹的目的是利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,防止Fe(OH)2被空气中氧气氧化;一段时间后,关闭止水夹,A中的氢气不能排出,在试管内使压强越来越大,把A中的硫酸亚铁赶入到B中,在B中会出现白色沉淀Fe(OH)2。
考点:考查铁与水蒸气反应的实验,检验二价铁及三价铁的方法,氢氧化亚铁的制备,铁三角的转化。
点评:对于铁单质及其化合物的转化是高中的重点和难点,经常以离子的检验、除杂、物质的制备等题型出现,比较综合,考查学生的综合思维能力。

(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。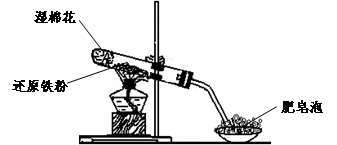
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2