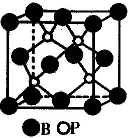
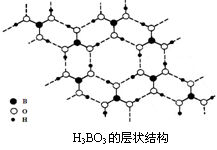
题目内容
A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,A与D同主族。B元素的氢化物水溶液能使红色石蕊试纸变蓝,C与E同主族,D与E同周期,E原子的最外层电子数等于两个内层电子数之差。回答下列问题:
(1)写出D元素的名称: ;比较原子半径B C(填“>”或“<”);
(2)由A、C、D元素形成的化合物中含有的化学键是 ;
(3)化合物A2C的电子式为 ;
(4)物质M由B元素的氢化物和最高价氧化物的水化物反应得到,则M属于 晶体(填原子、分子或离子);
(5)由A、C形成的化合物和C、E形成的化合物发生反应只生成强酸,其化学方程式为 。
(1)写出D元素的名称: ;比较原子半径B C(填“>”或“<”);
(2)由A、C、D元素形成的化合物中含有的化学键是 ;
(3)化合物A2C的电子式为 ;
(4)物质M由B元素的氢化物和最高价氧化物的水化物反应得到,则M属于 晶体(填原子、分子或离子);
(5)由A、C形成的化合物和C、E形成的化合物发生反应只生成强酸,其化学方程式为 。
(1)钠(1分);>(1分)(2)离子键和共价键(1分)(3) (1分)
(1分)
(4)离子(1分) (5)H2O2+SO2=H2SO4 或H2O+SO3=H2SO4(2分)
 (1分)
(1分) (4)离子(1分) (5)H2O2+SO2=H2SO4 或H2O+SO3=H2SO4(2分)
根据元素的结构、位置及有关性质可知A、B、C、D、E分别是H、N、O、Na、S。
(1)同周期自左向右原子半径直接减小,所以氮原子半径大于氧原子的。
(2)A、C、D元素形成的化合物是氢氧化钠,含有离子键和共价键。
(3)化合物A2C是H2O,含有极性键,电子式为 。
。
(4)氨气和硝酸反应生成硝酸铵,含有离子键,是离子化合物。
(5)A、C形成的化合物和C、E形成的化合物分别可以是H2O2和SO2、H2O和三氧化硫,所以方程式为H2O2+SO2=H2SO4 或H2O+SO3=H2SO4。
(1)同周期自左向右原子半径直接减小,所以氮原子半径大于氧原子的。
(2)A、C、D元素形成的化合物是氢氧化钠,含有离子键和共价键。
(3)化合物A2C是H2O,含有极性键,电子式为
 。
。(4)氨气和硝酸反应生成硝酸铵,含有离子键,是离子化合物。
(5)A、C形成的化合物和C、E形成的化合物分别可以是H2O2和SO2、H2O和三氧化硫,所以方程式为H2O2+SO2=H2SO4 或H2O+SO3=H2SO4。

练习册系列答案
相关题目
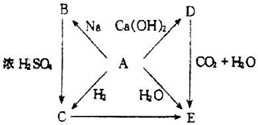
 ②
② 能与
能与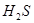 反应生成S
反应生成S 的酸性比
的酸性比 的强 ④常温下
的强 ④常温下