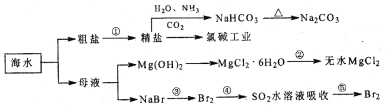
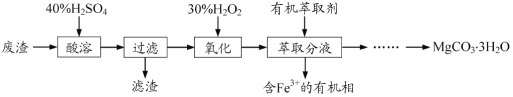
题目内容
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

【答案】 氧气与碳发生燃烧反应放热,放出的热被可逆反应吸收利用,促进反应正向移动 T1 < T2 < T3 T3 CO2 CO32- + H2S ![]() HS - + HCO3- 4H2+Fe3O4
HS - + HCO3- 4H2+Fe3O4 ![]() 3Fe+4H2O a c +330 kJ/mol
3Fe+4H2O a c +330 kJ/mol
【解析】I、(1)C(s)+H2O(g)![]() CO(g)+H2(g)△H=+135kJmol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)
CO(g)+H2(g)△H=+135kJmol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)![]() CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
(2)①反应CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41kJmol-1的正反应为放热反应,温度越高一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
CO2(g)+H2(g)△H=-41kJmol-1的正反应为放热反应,温度越高一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
②若煤气化反应I发生后的汽气比为0.8,设水蒸气的物质的量是4mol、则生成的CO物质的量为5mol,同时生成5mol氢气,经煤气化反应I和水气变换反应II后,设反应II中CO转化的为xmol,则生成xmol氢气,则(5-x):(5+x)=1:3,x=2.5,CO的转化率=![]() ×100%=50%,根据图知,反应温度为T3;
×100%=50%,根据图知,反应温度为T3;
(3)①根据方程式II知,生成的酸性气体还有二氧化碳;
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,则二者反应生成碳酸氢钾和硫氢化钾,反应方程式为K2CO3+H2S═KHS+KHCO3;
II、⑷由图示可知,过程II中氢气还原Fe3O4生成H2O,发生反应的化学方程式是4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I有氢气生成,而过程II中存在氢气还原四氧化三铁和CO还原四氧化三铁,均属于氧化还原反应,故a正确;b.过程II中使用的催化剂为Fe3O4和CaO,故b错误;c.若过程I投料![]() ,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程II中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程II中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
(6) CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)
起始物质的量(mol) 1.2 4.8 0 0
变化物质的量(mol) x 3x 2x 4x
平衡物质的量(mol) 1.2- x 4.8-3x 2x 4x
平衡时CH4的体积为![]() =
=![]() ,解得x=0.36mol,则
,解得x=0.36mol,则![]() H=+118.8×
H=+118.8×![]() kJ/mol=+330kJ/mol。
kJ/mol=+330kJ/mol。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案