题目内容
根据磷元素的原子结构示意图 ,做出如下推理,其中与事实不符的是( )
,做出如下推理,其中与事实不符的是( )
 ,做出如下推理,其中与事实不符的是( )
,做出如下推理,其中与事实不符的是( )分析:A.主族元素周期数=电子层数、主族族序数=最外层电子数;
B.非金属性越强,原子得电子能力越强;
C.氮气单质存在三键,化学性质稳定;
D.元素非金属性越强,氢化物越稳定.
B.非金属性越强,原子得电子能力越强;
C.氮气单质存在三键,化学性质稳定;
D.元素非金属性越强,氢化物越稳定.
解答:解:A.P元素原子有3个电子层,最外层有5个电子,位于元素周期表的第三周期第ⅤA族,故A正确;
B.非金属性N>P,S>P,则磷原子不如氮原子和硫原子的得电子能力强,故B正确;
C.氮气分子中含有N≡N三键,化学性质不活泼,不如磷单质活泼,故C错误;
D.非金属性N>P,S>P,磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定,故D正确,
故选C.
B.非金属性N>P,S>P,则磷原子不如氮原子和硫原子的得电子能力强,故B正确;
C.氮气分子中含有N≡N三键,化学性质不活泼,不如磷单质活泼,故C错误;
D.非金属性N>P,S>P,磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定,故D正确,
故选C.
点评:本题考查原子结构与元素周期律,把握元素周期律及非金属性的比较即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
|
根据磷元素的原子结构示意图所示,做出如下推理,其中与事实不符的是
| |
| [ ] | |
A. |
磷元素位于元素周期表的第三周期、第VA族 |
B. |
磷原子不如氮原子和硫原子的得电子能力强 |
C. |
磷单质不如氮气和硫单质的化学性质活泼 |
D. |
磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定 |


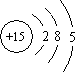 ,做出如下推理,其中与事实不符的是
,做出如下推理,其中与事实不符的是