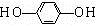题目内容
(2011?福建)Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是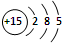
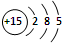 .
.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是
mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
该实验的目的是
Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
(1)磷元素的原子结构示意图是
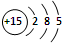
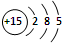
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有
20
20
mol电子发生转移.(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是
| 2aV1-bV2 |
| 2000 |
| 2aV1-bV2 |
| 2000 |
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol?L-1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol?L-1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
目的是探究该反应速率与温度的关系
目的是探究该反应速率与温度的关系
;表中V2=40
40
mLⅡ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
分解出HCl气体,抑制CeCl3水解
分解出HCl气体,抑制CeCl3水解
.(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
2
2
Ce3++1
1
H2O2+6
6
H2O═2
2
Ce(OH)4↓+6H+
6H+
.分析:Ⅰ、(1)依据核外电子排布规律,结合15号磷元素的磷原子结构画出;
(2)依据氧化还原反应的电子守恒,标注元素化合价,得到升高降低的总数相同金属得到;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应;
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系.
Ⅱ、(5)NH4Cl的作用是抑制CeCl3水解;
(6)“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式;
(2)依据氧化还原反应的电子守恒,标注元素化合价,得到升高降低的总数相同金属得到;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应;
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系.
Ⅱ、(5)NH4Cl的作用是抑制CeCl3水解;
(6)“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式;
解答:解:(1)P属于第15号元素,其原子的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4 mol=20 mol或C化合价由0价变成为+2价,电子转移为2×10 mol=20 mol,故答案为:20;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应,n(Na2S2O3)=
mol;
与其反应的碘单质为
mol,与维生素C反应的碘单质为
mol,
即维生素C的物质的量是
=
;
故答案为:
;
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:目的是探究该反应速率与亚硫酸钠浓度,反应温度的关系;40;
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可知NH4Cl的作用是分解出HCl气体,抑制CeCl3水解,
故答案为:分解出HCl气体,抑制CeCl3的水解;
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2;1;6;2;6H+.
 ,故答案为:
,故答案为: ;
;(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4 mol=20 mol或C化合价由0价变成为+2价,电子转移为2×10 mol=20 mol,故答案为:20;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应,n(Na2S2O3)=
| bV2 |
| 1000 |
与其反应的碘单质为
| bV2 |
| 2000 |
| 2aV1-bV2 |
| 2000 |
即维生素C的物质的量是
| 2aV1-bV2 |
| 2000 |
| aV1-0.5bV2 |
| 1000 |
故答案为:
| 2aV1-bV2 |
| 2000 |
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:目的是探究该反应速率与亚硫酸钠浓度,反应温度的关系;40;
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可知NH4Cl的作用是分解出HCl气体,抑制CeCl3水解,
故答案为:分解出HCl气体,抑制CeCl3的水解;
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2;1;6;2;6H+.
点评:本题考查化学方程式的配平与计算,滴定实验过程的分析计算应用,盐类水解的分析判断,难度较大,在氧化还原反应中得失电子总数相等是解题关键,注意审题.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 (2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )
(2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )
 +CH3CH2Cl
+CH3CH2Cl +HCl
+HCl