题目内容
【题目】按要求填空:
(1)原子序数为24的元素原子中有___________个电子层,___________个能级,_________个未成对电子,位于元素周期表的___________区。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是___________;只含有极性键的是___________;只含有离子键的是___________;既含有非极性键又含有极性键的是___________;含有非极性键的离子化合物是___________。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)。
【答案】 4 7 6 d ① ② ④ ⑤ ⑥ π
【解析】(1)原子序数为24,基态原子核外电子排布式为1s22s22p63s23p63d54s1,可知原子中有4个电子层,7个能级,6个价电子,6个未成对电子,最后填充d电子,则位于d区;
(2)①N2分子内只有非极性键;②H2O分子内只有极性键,是极性分子;③NaOH是含有离子键和极性共价键的离子化合物;④MgCl2是只含有离子键的离子化合物;⑤C2H4是含有极性键和非极性键的非极性分子;⑥Na2O2是含有离子键和非极性键的离子化合物;则只含有非极性键的是①;只含有极性键的是②;只含有离子键的是④;既含有非极性键又含有极性键的是⑤;含有非极性键的离子化合物是⑥;
(3)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为![]() kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定。
kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定。

【题目】用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2);恒温恒容容器,φ(NO2) .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是 . 变为曲线Z改变的条件是
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2﹣t4内 c(N2)的变化曲线.
【题目】无机化合物可根据其组成和性质进行分类, 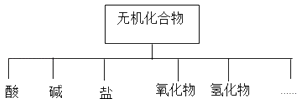
(1)如图所示的物质分类方法名称是 .
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 | ③NaOH | ⑤Na2SO4 | ⑦SO2 | ⑨NH3 |
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为: .
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于盐(填正盐、酸式盐或碱式盐).
