题目内容
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题..
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
二 | C | N | O | Ne | ||||
三 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为 .
(2)H2SO4与HClO4中,酸性较强的是 .
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是 . 它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为 .
【答案】
(1)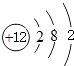
(2)HClO4
(3)Al(OH)3; Al(OH)3+3H+═Al3++3H2O
【解析】解:(1)Mg原子核外有12个电子,有3个电子层,各层电子数为2、8、2,原子结构示意图为: 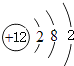 ,所以答案是:
,所以答案是: 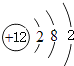 ;(2)同周期自左而右元素非金属性减弱,故非金属性S<Cl,元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4,
;(2)同周期自左而右元素非金属性减弱,故非金属性S<Cl,元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4,
所以答案是:HClO4;(3)氢氧化铝属于两性氢氧化物,胃酸主要成份为盐酸,氢氧化铝与盐酸反应生成氯化铝与水,反应化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O,离子反应方程式为:Al(OH)3+3H+═Al3++3H2O,所以答案是:Al(OH)3;Al(OH)3+3H+═Al3++3H2O.

【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)