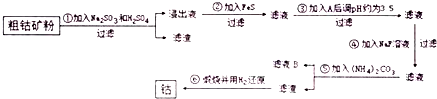
题目内容
8.已知A、B、C、D、E是短周期元素,它们的原子序数逐渐增大.A元素原子形成的离子没有电子;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳.(1)A的离子符号是H+;
(2)少量E的低价氧化物与C的最高价氧化物的水化物相互反应的离子方程式是SO2+2OH-=SO32-+H2O
(3)A、B、C三种元素形成的化合物所含的化学键类型是离子键、共价键;
(4)B、C、D三种元素分别形成的离子,离子半径由大到小的顺序是O2->Na+>Al3+(用离子符号填写).
(5)D单质与C最高价氧化物对应水化物反应的离子化学方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(6)E的氢化物与其低价氧化物反应生成3molE转移电子数为4×6.02×1023.
分析 A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,据此解答.
解答 解:A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,
(1)A的离子符号是H+,故答案为:H+;
(2)E的低价氧化物为SO2,C的最高价氧化物的水化物为NaOH,少量二氧化硫与氢氧化钠反应生成亚硫酸钠与水,反应离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(3)A、B、C三种元素形成的化合物为NaOH,钠离子与氢氧根离子以离子键结合,O、H原子之间以共价键结合,故答案为:离子键、共价键;
(4)B、C、D三种元素的离子分别为O2-、Na+、Al3+,三种离子核外电子排布相同,离子的核电核数越大,则半径越小,故离子半径O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)E的氢化物与其低价氧化物反应方程式为:2H2S+SO2=3S↓+H2O,生成3molS时参加反应的二氧化硫为1mol,二氧化硫中S元素由+4价降低为0价,故转移电子数为1mol×4×6.02×1023mol-1=4×6.02×1023,故答案为:4×6.02×1023.
点评 本题考查位置结构性质的相互关系及应用,推断元素是解题关键,侧重考查学生对基础知识的理解掌握,难度不大.

| 实验步骤 | 实验结论 |
(1)A的质谱图如图: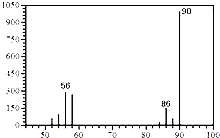 | (1)证明A的相对分子质量为:90. |
| (2)将此9.0g A在足量纯O 2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO 2 (标准状况). 往另一份A中加入足量的金属钠充分反应,生成2.24 L H 2(标准状况). | (3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: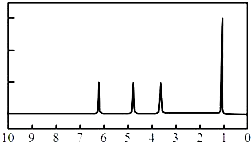 | (4)A的结构简式为:  . . |
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
①甲比乙容易与H2化合;
②甲原子能与乙阴离子发生置换反应;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙的低.
能说明甲比乙的非金属性强的是( )
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
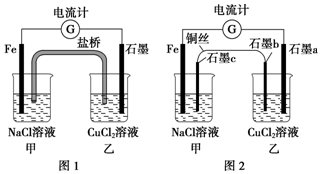 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
①在100℃,101KPa条件下,液态水气化热为40.69KJ•mol-1.则H2O(g)=H2O(l) H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③已知:
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
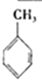 (g)+3H2(g)→
(g)+3H2(g)→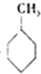 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
| A. | 14C的质量数为14g•mol-1 | B. | 14C与14N中子数一定不同 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与12C是两种不同的元素 |
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |