题目内容
工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
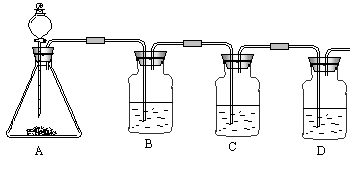
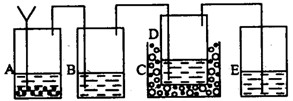
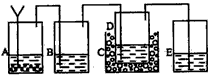
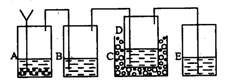
以上反应的总结果是放热反应。请设计一个实验:用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。可供选择的实验用品有:6mo1·L-1盐酸、6mo1·L-1硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。
(1)画出实验装置示意图(包括反应时容器中的物质),并用图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)。
(2)请写出在图上用A、B、C……各玻璃容器中盛放物质的化学式或名称。A:________,B:________C:________,D:________,E:________。
(3)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。答:________。
说明:①本题装置示意图中的仪器可以用下面的方式表示。敞口玻璃容器:![]() 有塞玻璃容器:
有塞玻璃容器:![]() 玻璃漏斗:
玻璃漏斗: ![]() 分液漏斗:
分液漏斗:![]() 玻璃导管:
玻璃导管:![]() (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的连接胶管等,在示意图中不必画出。如需
加热,在需加热的仪器下方,标以“△”表示。
解析:
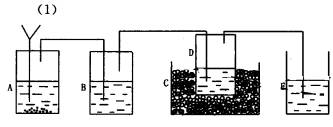
(2)A中盛放的是碳酸钙,B中盛放的是浓氨水,C中放的是冰,D中是食盐,E中是硫酸,用于吸收残余的氨气 (3)将最后得到的产品加热能产生刺激性气味气体,且该气体能使澄清石灰水变浑浊,这说明不是结晶氯化钠,而且是碳酸氢钠晶体。
|

| |||||||||||
 分液漏斗
分液漏斗