��Ŀ����
��ҵ��ˮ�г�����һ������Cr2O72����CrO42�������ǻ�����༰��̬ϵͳ�����ܴ���˺���������д������÷��Ĺ�������ΪCrO42��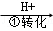 Cr2O72��
Cr2O72��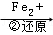 Cr3+
Cr3+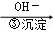 Cr(OH)3�� ���еڢٲ�����ƽ�⣺2CrO42������ɫ��+2H+
Cr(OH)3�� ���еڢٲ�����ƽ�⣺2CrO42������ɫ��+2H+ Cr2O72������ɫ��+H2O
Cr2O72������ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ�� ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬���� ����ѡ���ţ�
a��Cr2O72����CrO42����Ũ����ͬ b��v��(Cr2O72��)=2v��(CrO42��)
c����Һ����ɫ���� d����Һ��pHֵ����
��3��д���ڢڲ���Cr2O72��ת��ΪCr3+�����ӷ���ʽ�� ��
��4����Cr2(SO4)3��Һ�У��μ�NaOH����pH=4.6ʱ����ʼ����Cr(OH)3����������pH�����ߣ��������࣬����pH��13ʱ��������ʧ����������ɫ��[Cr��OH��4]�����ӣ���ƽ���ϵ���£�H++[Cr(OH)4]��������ɫ�� Cr��OH��3��s������ɫ��+H2O
Cr��OH��3��s������ɫ��+H2O  Cr3+����ɫ��+H2O +3OH��������0.05mol��L��1��Cr2(SO4)3��Һ50mL�У���������0.6mol��L��1��NaOH��Һ����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ ��
Cr3+����ɫ��+H2O +3OH��������0.05mol��L��1��Cr2(SO4)3��Һ50mL�У���������0.6mol��L��1��NaOH��Һ����ַ�Ӧ����Һ�пɹ۲쵽������Ϊ ��
��5����Na[Cr��OH��4]��Na2Cr2O7��Ϻ����Һ�м���H2SO4�ữ����Ԫ���� ��ʽ���ڣ���д���ӷ��ţ���
ͨ���۲컯ѧʵ�����������ɳ���ȷ�Ľ��ۣ���ѧϰ��ѧ��ѧ������ļ���֮һ��������ʵ������ó���ȷ���۵���
ѡ�� | ʵ������ | ���� |
A[] | ����ͬ��С��һ������þ�ֱ�Ͷ����ͬŨ�ȵ�NaOH��Һ�У����ܽ������ݷų�����þû���κα仯 | �ɴ˵ó������Ľ����Ա�þǿ |
B | ȡһ���������þƾ��Ƶ�ȼ������ֻ�ۻ���Һ���û������ | �ɴ˵ó���������ȼ�� |
C | ���Ȼ����Һ��Ͷ��һþƬ��þƬ�ϲ����������� | �ɴ˵ó����������ǰ��� |
D | ���Ȼ�����Һ����εμ�NaOH��Һ���������Ȳ�����ɫ��������������ܽ⣬��������ȫ��ʧ | �ɴ˵ó�����������������ǿ����Һ |




 ����еĹ����ţ�
����еĹ����ţ� ʱ������Ե��Թ��У�����������ȷ����
ʱ������Ե��Թ��У�����������ȷ����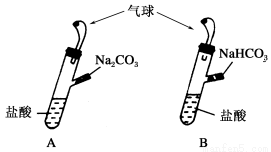

 H3O++OH�� B��CO32��+H2O
H3O++OH�� B��CO32��+H2O