题目内容
【题目】下列图示的四种实验操作名称从左到右依次是( ) 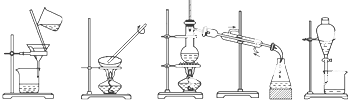
A.过滤、蒸发、蒸馏、分液
B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液
D.分液、蒸馏、蒸发、过滤
【答案】A
【解析】解:由图中第一个装置的仪器以及操作分离固液化合物,可知本实验操作名称过滤;
由图中第二个装置的仪器以及操作从溶液中分离溶质,可知本实验操作名称蒸发;
由图中第三个装置的仪器以及操作分离沸点不同的液体混合物,可知本实验操作名称蒸馏;
由图中第四个装置的仪器以及操作分离互不相溶的液体,可知本实验操作名称是萃取分液;
故四种实验操作名称从左到右依次是过滤、蒸发、蒸馏、萃取分液.
故选A.
【考点精析】通过灵活运用蒸发和结晶、重结晶,掌握结晶和重结晶是利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3即可以解答此题.

练习册系列答案
相关题目
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A. 0.1 mo1·L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L
B. c1一定大于0.2 mo1·L-1
C. 甲反应后的溶液中:HA占含A微粒总数的0.02%
D. 乙反应后的溶液中:c(Na+)<c(HA)+c(A一)