题目内容
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
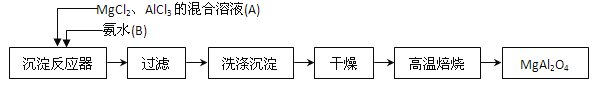
(1)写出AlCl3与氨水反应的化学反应方程式_________________________。
(2)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
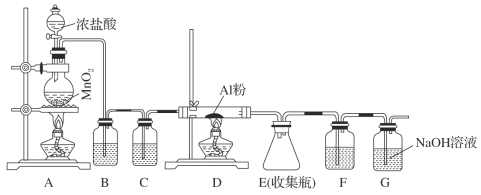
(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是__________________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:__________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案 (填“可行”,“不可行”),理由是_________________________。
【答案】(1)AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
(2)硝酸酸化的硝酸银 坩埚
(3)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(4)除去混在氯气中的氯化氢
(5)浓硫酸 Cl2+2NaOH=NaCl+NaClO+H2O
(6)不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
【解析】
试题分析:(1)MgCl2、AlCl3的混合溶液与氨水反应生成氢氧化镁和氢氧化铝沉淀,化学方程式为AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl;
(2)氯化镁与氯化铝在与氨水反应生成沉淀时,沉淀上易附着有氯离子,检验氯离子所用的试剂是硝酸银溶液;高温焙烧时,用于盛放固体的仪器是坩埚;
(3)装置A用来制备氯气,其离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去混在氯气中的氯化氢气体。
(5)由于氯化铝遇潮湿空气即产生大量白雾,所以需要防止水蒸气进入E装置中,则F中试剂是浓硫酸。G为尾气处理装置,其中反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(6)由于硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀,所以此方案不可行。

【题目】下列生实验事实或结论均正确的是
选项 | 事实 | 结论 |
A | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
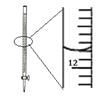
B |
| 记录滴定终点读数为12.20mL |
C | Mg(OH)2固体在溶液中存在平衡: Mg(OH)2(s) | 该固体不溶于NH4Cl溶液 |
D | 镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生同时测得溶液的pH为8.6 | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生,弱碱性溶液中OH- 氧化了Mg |
A. A B. B C. C D. D