题目内容
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:

(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
【答案】催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O 1.25×109 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3 ZnS
【解析】
(1)因为软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS),加稀硫酸会把这些金属氧化物变成离子, “酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是催化剂的作用,因为催化剂能够改变化学反应的速。MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。本题答案:催化剂 4MnO2+ZnS+4H2SO4=4MnSO4+ZnSO4+4H2O。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
ZnS+Mn2+(aq),该反应的平衡常数K=c(Mn2+)/c(Zn2+)。Ksp(ZuS)= c(Zn2+).c(S2-)
Ksp(MnS)=c(c(Mn2+). c(S2-), Ksp(MnS)/ Ksp(MnS)= c(Mn2+)/c(Zn2+)=K所以K=1.25×109
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(4)由(3)知强酸性条件下加入MnO2氧化Fe2+ 变成Fe3+ ,, Ksp(Fe(OH)3)=2.6![]() 10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
10-39“调节pH约为3~4时会出现Fe(OH)3沉淀。本题答案:Fe(OH)3。(写化学式)
(5)由 知该工艺流程中可以循环利用的物质是ZnS。
知该工艺流程中可以循环利用的物质是ZnS。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
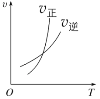
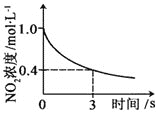
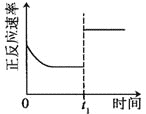
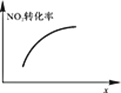
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D