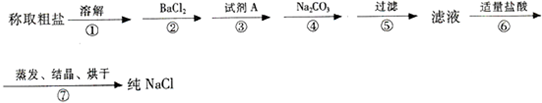
题目内容
用18mol?L-1浓硫酸配制100mL3.0mol?L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______?
D.定容时俯视刻度线______?
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是______,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______?
D.定容时俯视刻度线______?
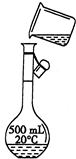
(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要浓硫酸的体积为V,则:
V×18mol?L-1=100mL×3.0mol?L-1
解得:V=16.7mL
需要量取浓硫酸16.7mL,故应选择25mL的量筒,
故答案为:16.7mL;B;
(2)A.浓硫酸具有吸水性,所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸的浓度变稀,实际量取的浓硫酸中溶质硫酸的物质的量偏小,所配溶液的浓度偏小,
故答案为:偏小;
B.溶液配制需加水定容,容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度无影响,故答案为:无影响;
C.所用过的烧杯、玻璃棒未洗涤,少量硫酸沾在烧杯壁、玻璃棒上,移入容量瓶内硫酸的物质的量减少,所配溶液浓度偏小,故答案为:偏小;?
D.定容时俯视刻度线,导致液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故答案为:偏大.
V×18mol?L-1=100mL×3.0mol?L-1
解得:V=16.7mL
需要量取浓硫酸16.7mL,故应选择25mL的量筒,
故答案为:16.7mL;B;
(2)A.浓硫酸具有吸水性,所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸的浓度变稀,实际量取的浓硫酸中溶质硫酸的物质的量偏小,所配溶液的浓度偏小,
故答案为:偏小;
B.溶液配制需加水定容,容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度无影响,故答案为:无影响;
C.所用过的烧杯、玻璃棒未洗涤,少量硫酸沾在烧杯壁、玻璃棒上,移入容量瓶内硫酸的物质的量减少,所配溶液浓度偏小,故答案为:偏小;?
D.定容时俯视刻度线,导致液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故答案为:偏大.

练习册系列答案
相关题目