题目内容
【题目】检验某溶液中是否含有K+、Fe3+、Cl﹣、Mg2+、I﹣、CO32﹣、SO42﹣ , 限用的试剂有:盐酸硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( ) 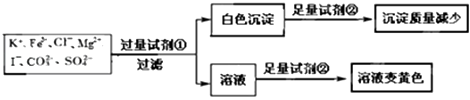
A.该溶液中一定有I﹣、CO32﹣、SO42﹣、K+
B.试剂①为硝酸钡
C.通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl﹣
D.试剂②一定为盐酸
【答案】C
【解析】解:由实验可知,加试剂①为硝酸钡溶液,生成白色沉淀为碳酸钡和硫酸钡,则加试剂②为盐酸,沉淀减少,硫酸钡不溶于酸,则原溶液中一定存在CO32﹣、SO42﹣ , 则不含Fe3+、Mg2+;加试剂①过滤后的滤液中,再加试剂②为盐酸,氢离子,硝酸根离子、I﹣发生氧化还原反应生成碘,溶液为黄色,溶液为电中性,则一定含阳离子为K+ ,
A.由上述分析可知,该溶液中一定有I﹣、CO32﹣、SO42﹣、K+ , 故A正确;
B.由上述分析可知,试剂①为硝酸钡,故B正确;
C.黄色溶液中加入硝酸银可生成AgI沉淀,试剂②加盐酸引入氯离子,不能检验原溶液中是否存在Cl﹣ , 故C错误;
D.由上述分析可知,试剂②一定为盐酸,因碳酸钡与硫酸反应生成硫酸钡使沉淀量增加,故D正确;
故选C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
