题目内容
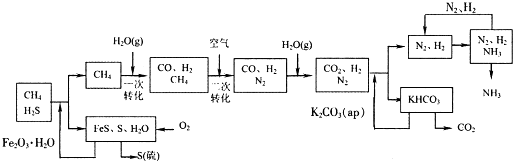
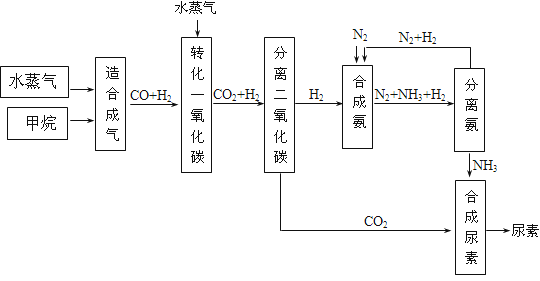
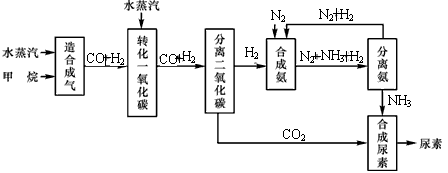
四川有丰富的天然气资源.以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
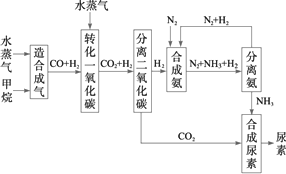
请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:_________.
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气.请运用化学反应速率和化学平衡的观点说明采取该措施的理由:_________.
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成_________L氨气.(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为![]() ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①_________;②_________.
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①_________;②_________.
解析:
|
答案:(1)CH4(g)+H2O(g) (2)增大氮气和氢气的浓度有利于加快反应速率;减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向生成氨气的方向移动 (3)1.12×108 (4)① 解析:(1)0.5 mol CH4与0.5 mol水蒸气反应吸收a kJ热量,则1 mol CH4与1 mol水蒸气反应吸收2a kJ热量,按照热化学方程式的书写原则即可写出该反应的热化学方程式. (2)合成氨的反应3H2+N2 (3)根据反应CH4+H2O (4)根据尿素的结构简式将一个-NH2中的-NH-移动可得到一种同分异构体: |

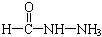

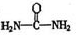 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①
,②
。
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①
,②
。
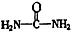 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①__________________ ,②_______________________ 。
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①__________________ ,②_______________________ 。