题目内容
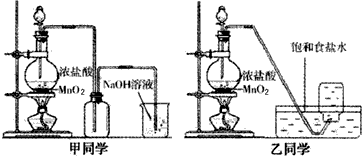
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.
现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应).计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应).计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
分析:根据n=
计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量、参加反应的HCl的物质的量,利用V=nVm计算氯气的体积.
| m |
| M |
解答:解:17.4gMnO2的物质的量=
=0.2mol,则:
(1)设生成的Cl2的体积为V,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1mol 22.4L
0.2mol V
所以,V=
=4.48L,
答:生成的Cl2的体积在标准状况下为4.48L;
(2)设参加反应的HCl的物质的量为n,则:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1mol 4mol
0.2mol n
所以,n=
=0.8mol,
答:参加反应的HCl的物质的量为0.8mol.
| 17.4g |
| 87g/mol |
(1)设生成的Cl2的体积为V,
MnO2+4HCl(浓)
| ||
1mol 22.4L
0.2mol V
所以,V=
| 0.2mol×22.4L |
| 1mol |
答:生成的Cl2的体积在标准状况下为4.48L;
(2)设参加反应的HCl的物质的量为n,则:
MnO2+4HCl(浓)
| ||
1mol 4mol
0.2mol n
所以,n=
| 0.2mol×4mol |
| 1mol |
答:参加反应的HCl的物质的量为0.8mol.
点评:本题考查根据化学方程式的相关计算,题目难度不大,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目