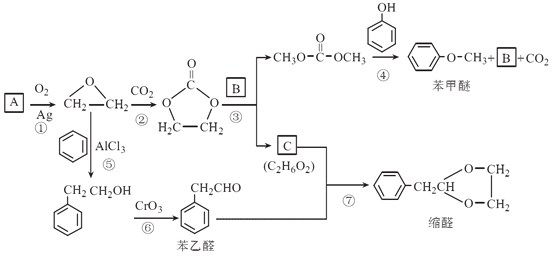
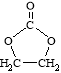
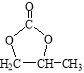
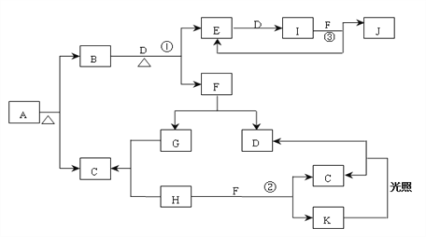
题目内容
【题目】某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
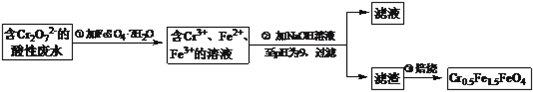
(1)第①步反应的离子方程式是____________________;
(2)第②步中用pH试纸测定溶液pH的操作是:________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________;
(4)欲使1L该废水中Cr2O72-的完全转化为Cr0.5Fe1.5FeO4。理论上需要加入____FeSO4·7H2O。
【答案】 Cr2O72-+6Fe2++14H+==2Cr3+ +6Fe3++7H2O 将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。 Fe(OH)3、Fe(OH)2 13.9 g
【解析】(1)Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上;故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)由题给框图可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,故答案为:Fe(OH)3、Fe(OH)2;
(4)1 L废水中含n(Cr2O72-)=5.00×10-3 mol。根据Cr原子、Fe原子守恒,可得:Cr2O72-~~~4Cr0.5Fe1.5FeO4~~~10FeSO47H2O,所以理论上n(FeSO47H2O)=10n(Cr2O72-)=5.00×10-3 mol×10=0.05 mol,所以m(FeSO47H2O)=0.05 mol×278 g/mol=13.9 g,故答案为:13.9g。

【题目】下表各选项中.由Y得到W不能通过置换反应一步实现的是
化合物 选项 | A | B | C | D |
Y | CO2 | Fe2O3 | C2H5OH | FeCl3 |
W | MgO | Al2O3 | C2H5ONa | CuCl2 |
A. A B. B C. C D. D