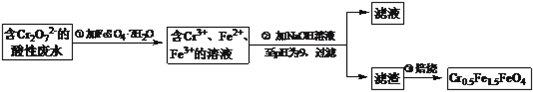��Ŀ����
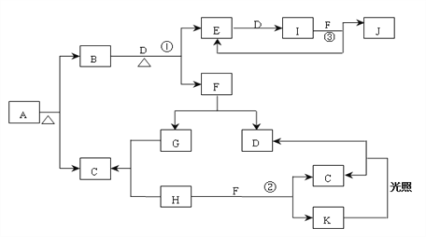
����Ŀ����֪��AΪ���Σ����¡���ѹ�£�B��C��D��E��G��H��I��Ϊ���壬����D��G��HΪ���ʣ�����B��ʹʪ���ɫʯ����ֽ����������E����Ϊ��ɫ���壬����������Ӵ�������һ�ֺ���ɫ����I��HΪ����ɫ���塣F�ڳ�������һ����ɫҺ�塣C��J��ˮ��Һ�ֱ�Ϊ����ǿ�ᡣͼ�з�Ӧ�������������⣩������ȥ��
��д�����ǵĻ�ѧʽ�� A________��C________��J________��
��ʵ�����Ʊ�����B�Ļ�ѧ��Ӧ����ʽΪ______��
��д��B+D��E+F�Ļ�ѧ��Ӧ����ʽ��______��
�� J��Ũ��Һ�뵥��Ag��Ӧ�����ӷ���ʽΪ��______��
���𰸡� NH4Cl HCl HNO3 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O 4NH3+5O2
CaCl2+2NH3��+2H2O 4NH3+5O2![]() 4NO+6H2O Ag + 2H++NO3-
4NO+6H2O Ag + 2H++NO3-![]() Ag+ + NO2 ��+H2O
Ag+ + NO2 ��+H2O
��������AΪ���Σ����¡���ѹ�£�B��C��D��E��G��H��I��Ϊ���壬����D��G��HΪ���ʣ�����B��ʹʪ���ɫʯ����ֽ������BΪ����������E����Ϊ��ɫ���壬����������Ӵ�������һ�ֺ���ɫ����I��EΪNO��IΪNO2�����ݿ�ͼ��DΪ������J��ˮ��ҺΪǿ�ᣬJΪ���HΪ����ɫ���壬HΪCl2��F�ڳ�������һ����ɫҺ�壬FΪˮ��DΪ��������GΪ������CΪ�Ȼ��⣬��AΪ�Ȼ�泥�������ˮ��Ӧ��������ʹ����ᣬ��KΪ�����ᡣ
��1����������������AΪNH4Cl ��CΪHCl��JΪHNO3���ʴ�Ϊ��NH4Cl ��HCl�� HNO3��
��2��ʵ�����Ʊ����就���Ļ�ѧ��Ӧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2
CaCl2+2NH3��+2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��3��B+D��E+F�Ļ�ѧ��Ӧ����ʽΪ4NH3+5O2![]() 4NO+6H2O���ʴ�Ϊ��4NH3+5O2
4NO+6H2O���ʴ�Ϊ��4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
��4��Ũ�����뵥��Ag��Ӧ�����ӷ���ʽΪAg + 2H++NO3-![]() Ag+ + NO2 ��+H2O���ʴ�Ϊ��Ag + 2H++NO3-
Ag+ + NO2 ��+H2O���ʴ�Ϊ��Ag + 2H++NO3-![]() Ag+ + NO2 ��+H2O��
Ag+ + NO2 ��+H2O��

����Ŀ��[���ʽṹ������]��Ԫ�غ�±��Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ�����⡣
��1����ļ۵����Ų�ʽΪ ��PCl3�Ŀռ乹��Ϊ ��
��2����֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������� ʽ����:
A��CsICl2=CsCl+ICl B��CsICl2=CsI+Cl2
��3�������±���һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ����__________
�� | �� | �� | �� | |
��һ�����ܣ�kJmol��1�� | 1681 | 1251 | 1140 | 1008 |
��4�����з��ӼȲ�����s��p�Ҽ���Ҳ������p��p�м�����
A�� HCl B��HF C�� SO2 D�� SCl2
��5����֪COCl2Ϊƽ���Σ���COCl2����̼ԭ�ӵ��ӻ��������Ϊ ��д��CO�ĵȵ�������� ��д��1������
��6������������ȼ��ʱ�õ�һ�ָƵ������ᄃ�壬��ṹ��ͼ��ʾ���ɴ˿��жϸøƵ�������Ļ�ѧ ʽΪ ����֪����������ܶ��Ǧ�gcm��3���������������������Ӽ�ľ���Ϊ cm��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA����