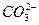题目内容
取一定量的镁、铝混合粉末,加入1 mol·L-1的硫酸300 mL,使之完全溶解(酸过量);再加入过量的未知浓度的KOH溶液200 mL,得到5.8 g沉淀;过滤后向滤液中加入2 mol·L-1盐酸100 mL,恰好沉淀完全;将沉淀滤出,洗涤、干燥,称量为7.8 g。求:
(1)原来混合物中镁和铝的质量分数;
(2)所用KOH的物质的量浓度。
(1)原来混合物中镁和铝的质量分数;
(2)所用KOH的物质的量浓度。
原来混合物中镁和铝的质量分数分别为:47%、53%,所用KOH的物质的量浓度4 mol·L-1。
(1)n(Mg)=n〔Mg(OH)2〕="5.8" g/58 g·mol-1="0.1" mol
n(Al)=n〔Al(OH)3〕="7.8" g/78 g·mol-1="0.1" mol
m(Mg)="0.1" mol×24 g·mol ="2.4" g
m(Al) ="0.1" mol×27 g·mol="2.7" g
w(Mg)=[2.4 g/(2.4 g+2.7 g)]×100%=47%
w(Al) =1-47%=53%
(2)恰好完全反应时溶液中存在的溶质是K2SO4、KCl,由电荷守恒得:n(K+)=2n(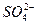 )+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。
)+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。
则c(KOH)="0.8" mol/0.2 L="4" mol·L-1。
n(Al)=n〔Al(OH)3〕="7.8" g/78 g·mol-1="0.1" mol
m(Mg)="0.1" mol×24 g·mol ="2.4" g
m(Al) ="0.1" mol×27 g·mol="2.7" g
w(Mg)=[2.4 g/(2.4 g+2.7 g)]×100%=47%
w(Al) =1-47%=53%
(2)恰好完全反应时溶液中存在的溶质是K2SO4、KCl,由电荷守恒得:n(K+)=2n(
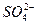 )+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。
)+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。则c(KOH)="0.8" mol/0.2 L="4" mol·L-1。

练习册系列答案
相关题目
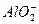 +H2↑
+H2↑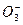 +CO2+3H2O====2Al(OH)3↓+
+CO2+3H2O====2Al(OH)3↓+