题目内容
【题目】在相同温度下,0.01molL﹣1 NaOH溶液和0.01molL﹣1的盐酸相比,下列说法正确的是( )
A.由水电离出的[H+]相等
B.由水电离出的[H+]都是1.0×10﹣12 molL﹣1
C.由水电离出的[OH﹣]都是0.01 molL﹣1
D.两者都促进了水的电离
【答案】A
【解析】解:A、温度一定,溶液中存在离子积常数,0.01mol/L NaOH溶液中水电离出的c(H+)水= ![]() mol/L,0.01mol/L的盐酸溶液中水电离出的c(H+)水=c(OH﹣)水=
mol/L,0.01mol/L的盐酸溶液中水电离出的c(H+)水=c(OH﹣)水= ![]() mol/L,所以由水电离出的c(H+)相等,故A正确;B、温度不一定是常温下,离子积常数不一定是10﹣14 , 计算出的水电离出的c(H+)不一定是1.0×10﹣12 mol/L,故B错误;
mol/L,所以由水电离出的c(H+)相等,故A正确;B、温度不一定是常温下,离子积常数不一定是10﹣14 , 计算出的水电离出的c(H+)不一定是1.0×10﹣12 mol/L,故B错误;
C、水电离出的氢离子和氢氧根离子浓度相同,温度不知,水电离出的c(H+)水=c(OH﹣)水= ![]() mol/L,故C错误;
mol/L,故C错误;
D、酸、碱均抑制水的电离平衡,故D错误;故选A.
水的电离方程式为:H20=H++OH﹣ , 加入酸或碱后,增大氢离子或氢氧根离子浓度导致水的电离平衡向逆反应方向移动,即抑制水的电离,依据溶液中离子积常数计算水电离出离子的浓度.

【题目】据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=﹣989.2kJmol﹣1 , 有关键能数据如下表:
化学键 | Si﹣O | O=O | Si﹣Si |
键能kJmol﹣1 | x | 498.8 | 176 |
已知1molSi中含2molSi﹣Si键,1molSiO2中含4molSi﹣O键,则x的值为 .
(2)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是 .
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,可以使反应SiO2+2C ![]() Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
(3)工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJmol﹣1 , 生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好完全被吸收,则上述制备纯硅的反应过程中(填“吸收”或“释放”)的热量为kJ.
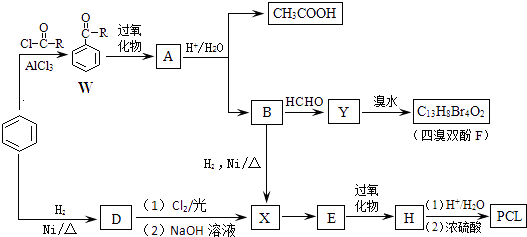
【题目】下表各组物质之间通过一步反应能实现如图所示转化关系,且与表中的条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件 |
|
A | NO | NO2 | HNO3 | ②加H2O | |
B | Al | NaAlO2 | AlCl3 | ③电解 | |
C | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
D | NaOH | NaHCO3 | NaCl | ④依次通入CO2、NH3 |
A.A
B.B
C.C
D.D