题目内容
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
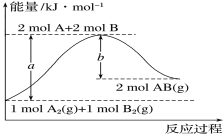
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
【答案】D
【解析】
化学反应A2(g)+B2(g)=2AB(g)的能量变化依据图象分析,结合反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,反应过程中断裂化学键需要吸收能量,形成化学键放出热量。
A、形成化学键放出热量,每生成2mol AB放出bkJ热量,故A错误;
B、断裂1molA-A键和1molB-B键,吸收a kJ能量,故B错误;
C、反应是吸热反应,依据能量守恒可知,反应中反应物的总能量低于生成物的总能量,故C错误;
D、该反应焓变=断裂化学键吸收热量-形成化学键所放出热量,所以焓变为△H=+(a-b)kJ·mol-1;故D正确;
故选D。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
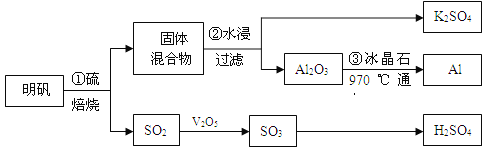
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。