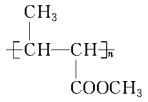
��Ŀ����
����Ŀ�������к���C��N��Mn��Ԫ�أ�ʵ���г��ù��������������ⶨ�������̵ĺ�������Ӧԭ��Ϊ2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
��1��Mnԭ�ӵļ۲���ӵĹ���Դ�ʽ�������Ų�ͼ��Ϊ______��
��2����֪H2S2O8�Ľṹ��ʽ��ͼ��ʾ��
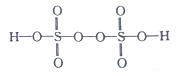
��H2S2O8��S�Ĺ���ӻ���ʽΪ______��H��O��S����Ԫ���У��縺������Ԫ����_________����Ԫ�ط��ţ���
��S��̬ԭ���е��ӵ��˶�״̬��_________�֡�
��������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ________������Ҽ����м���) ��ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ_________NA��
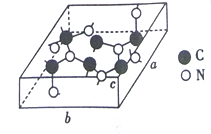
��3��C��N���γɶ��ֽṹ�ľ��塣һ�����͵ij�Ӳ���������ڽ��ʯ�Ľṹ����Ӳ�ȱȽ��ʯ���侧����ͼ��ʾ��ͼʾԭ�Ӷ������ھ����ڣ����仯ѧʽΪ________����֪��������a=0.64nm, b=0.55nm��c=0.24nm����þ�����ܶ�Ϊ________���г�ʽ�Ӽ��ɣ���ʽ���в�������ĸ��g/cm3��
���𰸡� ![]() sp3 O 16 �Ҽ� 2.5 C3N4
sp3 O 16 �Ҽ� 2.5 C3N4 ![]()
����������1��Mnԭ�ӵļ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ![]() ����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O
����2����H2S2O8��S��4��Oԭ���γ�4������������ӻ���ʽΪsp3��ͬ�������϶��µ�һ�����ܼ�С��H��O��S����Ԫ���У��縺������Ԫ����O����SԪ��Ϊ16��Ԫ�أ�ԭ�Ӻ�����16�����ӣ�ÿ�����ӵ��˶�״̬����ͬ������16�ֲ�ͬ�ĵ�������������Ӧ��S2O82-���ѵĹ��ۼ�����Ϊ������������ ��2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=
2MnO4-+10SO42-+16H+��ÿ����2molMnO4-,����5mol���ۼ�����ÿ����1molMnO4-,���ѵĹ��ۼ���ĿΪ2.5NA����3����������6��C��8��N���ʻ�ѧʽΪC3N4����=m/V=![]() ��
��

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�