题目内容
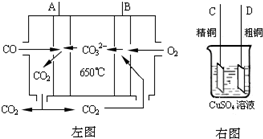
燃料电池能使燃料(H2、烃等)和氧气发生化学反应,使化学能转化为电能.燃料电池体积小、功率大,是正在研制的新能源之一.如用乙烷为燃料,氧气为氧化剂,电极用多孔镍板,电解质溶液为30% KOH溶液,组成一种燃料电池.有关该电池的说法正确的是
- A.通入乙烷的电极为正极
- B.通入氧气的电极为负极
- C.溶液里K+移向正极
- D.溶液的pH不断变大
C
解析:
解析:该题着重考查自学能力和逻辑思维能力.解答该题的关键是抓住原电池反应的原理是氧化还原反应,氧化反应在负极发生:C2H6-14e-+18OH-→2CO32-+12H2O,还原反应在正极发生:O2+4e-+2H2O→4OH-.综合考虑可选出答案为C.
解析:
解析:该题着重考查自学能力和逻辑思维能力.解答该题的关键是抓住原电池反应的原理是氧化还原反应,氧化反应在负极发生:C2H6-14e-+18OH-→2CO32-+12H2O,还原反应在正极发生:O2+4e-+2H2O→4OH-.综合考虑可选出答案为C.

练习册系列答案
相关题目
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H